Enraf-Nonius Endopress 442 Benutzerhandbuch
- Typ
- Benutzerhandbuch

Endopress 442
Benutzerhandbuch

Copyright:
Enraf-Nonius BV
Postfach 12080
3004 GB Rotterdam
Die Niederlande
Tel.: +31 (0)10 – 20 30 600
Fax: +31 (0)10 – 20 30 699
www.enraf-nonius.com
Artikel-Nr.: 1442752-41
19. September 2011

1
Endopress 442
Benutzerhandbuch

2
Inhaltsverzeichnis
1 VORWORT 4
1.1 Dieses Handbuch.............................................................................................................. 4
1.2 Produkthaftung .................................................................................................................4
2 BEABSICHTIGTER VERWENDUNGSZWECK 4
2.1 Das Lymphsystem ............................................................................................................ 5
2.1.1 Hauptgruppen der Lymphknoten der unteren Gliedmaßen 6
2.1.2 Grobkonzepte der Casley-Smith-Pumpe zur Lymphzirkulation 6
2.1.3 Bedeutung des Drucks zwischen Lymph- und Geweberaum 7
2.2 Indikationen....................................................................................................................... 8
2.3 Kontraindikationen ........................................................................................................... 8
3 ALLGEMEIN 8
4 EINRICHTUNG 9
4.1 Auspacken......................................................................................................................... 9
4.1.1 Standardzubehör: 9
4.1.2 Optionales Zubehör: 9
4.1.3 Umgebungsbedingungen für den Normalbetrieb 9
4.2 Elektrischer Anschluss .................................................................................................... 9
5 GEBRAUCHSANLEITUNG 10
5.1 Betriebsinformationen.................................................................................................... 10
5.2 Bedienteile an der Vorderseite ...................................................................................... 10
5.3 Bedienteile an der Rückseite......................................................................................... 11
5.4 Einschalten des Geräts .................................................................................................. 11
5.5 Hauptmenü ......................................................................................................................11
5.6 Installation und Standardeinstellung............................................................................ 12
5.6.1 Standardeinstellungen 12
5.7 Erste Schritte................................................................................................................... 14
5.7.1 Ein Programm auswählen 14
5.8 Druck-Einstellungen ....................................................................................................... 15
5.8.1 Für einen gleichmäßigen Druck in allen Segmenten 16
5.8.2 Individuelle Einstellung pro Segment 16
5.8.3 Ein persönliches Programm Schritt für Schritt anlegen 18
6 WARTUNG UND PROBLEMLÖSUNG 19
6.1 Wartung durch den Benutzer......................................................................................... 19
6.1.1 Reinigung der Manschetten 20

3
6.1.2 Reinigung des Gerätes 20
6.2 Lebensende..................................................................................................................... 20
7 PROBLEMLÖSUNG 20
7.1.1 Checkliste 21
8 ELEKTROMAGNETISCHE STÖRUNG 22
9 TECHNISCHE DATEN 22
10 ANHANG 1 23
10.1 Basisprotokolle............................................................................................................... 23

4
1 Vorwort
1.1 Dieses Handbuch
Dieses Handbuch wurde für die Eigentümer und Benutzer der Endopress 442 erstellt. Es
enthält allgemeine Anweisungen zu Betrieb, Wartung und Sicherheitsvorkehrungen sowie
Ersatzteilinformationen. Um die Verwendung, Effizienz und Nutzungsdauer Ihres Gerätes zu
maximieren, sollten Sie dieses Handbuch aufmerksam durchlesen und sich mit den
Bedienelementen und dem Zubehör vertraut machen, bevor Sie das Gerät in Betrieb nehmen.
Die in diesem Handbuch angegebenen Spezifikationen waren zum Zeitpunkt ihrer
Veröffentlichung korrekt. Auf Grund der Unternehmenspolitik von Enraf-Nonius BV, seine
Produkte kontinuierlich zu verbessern, können die Spezifikationen jederzeit und ohne
Verpflichtungen für Enraf-Nonius BV geändert werden.
1.2 Produkthaftung
In vielen Ländern ist ein Gesetz über die Produkthaftung in Kraft. Dieses Gesetz besagt unter
anderem, daß 10 Jahre nachdem ein Produkt in den Verkehr gebracht wurde, der Hersteller
nicht mehr für eventuelle Mängel am Produkt haftbar gemacht werden kann.
Die Enraf-Nonius B.V., beziehungsweise die vertraglich von Enraf-Nonius B.V. angestellten
Lieferanten und Verkäufer, werden keinerlei Verantwortung aufnehmen und/oder haften, für den
von Ihnen erlittenen Verlust oder Schaden (inkl. und ohne Einschränkung, für den direkten
Verlust oder Schaden, den indirekten Verlust oder Folgeschaden, den Verlust des Goodwills,
den Verlust verpasster Chancen und/oder den Daten- oder Gewinnverlust), der sich aus der
Anwendung oder der Unmöglichkeit der Answendung des Produktes ergibt (soweit dies nicht
mit der zutreffende Gesetzgebung in Widerspruch ist).
Die vorherige Aussage ist auch gültig selbst wenn Enraf-Nonius bzw. Lieferanten oder
Verkäufer informiert sind über die Möglichkeit eines solchen Schadens, und ungeachtet der
Recht- und Billigkeitstheorie (Vertrag, widerrechtliche Tat oder dergleichen), worauf der
Anspruch beruht.
Enraf-Nonius wird auf Grund von Klauseln in diesem Vertrag auf keinen Fall haftbar sein für
Schaden, der höher ist als der Betrag, den Enraf-Nonius für dieses Produkt von Ihnen
empfangen hat, einschließlich eventueller Vergütungen für Benutzungsunterstützung, die Enraf-
Nonius aus einem separaten Vertrag für Benutzungsunterstützung von Ihnen empfangen hat.
Wenn die zutreffende Gesetzgebung eine Haftungsbeschränkung im Falle von Tod oder
Körperschaden als Folge von Nachlässigkeit von Enraf-Nonius verbietet, ist die hier
beschriebene Haftungsbeschränkung ungültig.
Enraf-Nonius ist nicht haftbar für Folgen, die von unrichtigen Informationen und Empfehlungen
ihrer Mitarbeiter stammen sowie für Fehler, die aus dieser Gebrauchsanleitung sowie anderer
Begleitschreiben (einschließlich kommerzieller Dokumentationen) stammen. Die Gegenpartei
(Benutzer oder sein Repräsentant) ist verpflichtet, Enraf-Nonius gegen Haftpflicht von Dritten
(unabhängig von wem und aufgrund welcher Bestimmungen) zu schützen.
Enraf-Nonius versucht so akkurat wie möglich zu sein bei der Gestaltung ihrer Produkten und
der Dokumentation. Es ist leider nicht immer möglich fehlerfrei eine Übersetzung zu gestalten.
Übersetzungen aller Dokumenten sind aus der höllandische Sprache hervorgekommen. Falls
es Fragen gibt welcher basiert sind auf die Wiedergabe von Auskünfte in eine bestimmte
Übersetzung dann ist nur die höllandische Variante verbindlich. Mögliche Abweichungen oder
Unterscheiden welcher während des übersetzen entstanden sind, sind nicht verbindlich
während eines gerichtliches Disput oder rechtmässiger Angelegenheiten.
2 Beabsichtigter Verwendungszweck
Die Endopress 442 ist ein Gerät zur Kompressionstherapie. Das Endopress-System 442
funktioniert mit pneumatischen Bein- und Armmanschetten für eine invasivfreie Behandlung von
Lymphödemaen, Veneninsuffizienzen sowie einigen chronischen, nicht abheilenden Wunden
und Geschwüren

5
Die Segmente der Manschette füllen sich mit Luft, wodurch die Kompression in dem Arm oder
Bein bis zu dem eingestellten Druck ansteigt.
Der Endopress 442 sollte nur von qualifiziertem Personal betrieben werden. Auf diese Weise ist
sowohl die angemessene Nutzung als auch die Sicherheit des Patienten gewährleistet.
2.1 Das Lymphsystem
Die Hauptaufgabe des Lymphsystems besteht darin, ein korrektes Gleichgewicht im
Wassergewebe aufrecht zu erhalten: Diese Maßnahme wird an den Lymphen durchgeführt, um
sie von den Substanzen zu reinigen, die sie von Außen "gesammelt" haben, und dann in den
Kreislauf zurückzusenden, um ihre Aufgaben wahrzunehmen.
Diese Maßnahme entwickelt sich in der Regel an den Orten, an denen eine
"Flüssigkeitsstagnation" aus verschiedenen Gründen angezeigt wird.
In struktureller Hinsicht ist das Lymphsystem mit dem bekannteren Venensystem vergleichbar.
Es verzweigt sich in die Peripheriekanäle und "Aufnahmezentren", die über verschiedene
Ebenen verteilt sind.
Die oberflächlichen Lymphgefäße unterscheiden sich von den tieferliegenden Gefäßen in den
unteren Gliedmaßen.
Die oberflächlichen Gefäße verlaufen an der Oberfläche und bilden den Ursprung für ein
umfangreiches Lymph-Netzwerk, das sich über die plantare und dorsale Oberfläche der Füße
verteilt. Die tieferen Gefäße begleiten die tiefen Blutgefäße und erfassen die Lymphe, die von
den Muskeln und den Knochen der unteren Extremitäten stammen.
Die oberflächlichen Lymphgefäße nähern sich in den inguinalen Lymphknoten, die sich an der
Oberfläche in der Falte der Leistengegend befinden.
Stellen mit der höchsten Lymphknoten-Konzentration
(Ellbogen, Knie und entlang des Kragens sind geringfügig geringer).
Die Pfeile zeigen die Lymph-Fließrichtung an.
Die tiefen Lymphgefäße treffen auf ihrem Weg auf die vorderen tibialen Lymphknoten, die sich
im höheren, vorderen Teil des Beines befinden, und die Lymphknoten der Kniekehle (4 -5), die
an der hinteren Stirnfläche des Knies zu finden sind. Sie erreichen dann die tiefen Inguinal-
Lymphknoten, die sich tief in der Inguinalgegend befinden.

6
Zusätzlich zu den oberflächlichen Lymphgefäßen der unteren Extremitäten erfassen die
oberflächlichen inguinalen Lymphknoten (18 - 20) die Lymphgefäße der Gesäßbacken, des
Perineums, des Anus, der äußeren Geschlechtsorgane und des unteren Teil des Unterleibs.
Zusätzlich zu den tiefen Lymphgefäßen der Kniekehle erfassen die tiefen inguinalen
Lymphknoten (2 - 3) das Meiste, das von den oberflächlichen inguinalen Lymphknoten stammt.
Der größte dieser Lymphknoten wird Cloquet-Lymphknoten genannt und ist höher und tiefer
gelegen als die anderen und ragt daher in die Bauchhöhle.
2.1.1 Hauptgruppen der Lymphknoten der unteren Gliedmaßen
Diese Lymphknotenzentren der unteren Gliedmaßen spielen bei der Funktion des gesamten
Systems eine sehr wichtige Rolle, da sie als Aufnahmereservoirs dienen und auch die Lymphe
von den unteren Gliedmaßen reinigen. Die Lymphe bleibt so lange in diesen Zentren, bis sie
gefiltert (d. h. gereinigt) ist, und wird dann mit einem Anstieg der Diurese in das Nierensystem
zurückgeleitet. Dieser Anstieg der Diurese wird häufig nach einer Therapie mit Drucksystemen
(Massage-Drucktherapie) festgestellt und bestätigt die Aktivierung der
Lymphsystemmechanismen im Gewebe der unteren Extremitäten.
2.1.2 Grobkonzepte der Casley-Smith-Pumpe zur Lymphzirkulation
Die Lymphzirkulation ist nicht nur ein System, das im Falle einer "Überfüllung" eingreift, sondern
auch eine schnelle Absorption von Proteinen und Kolloiden ermöglicht.
Dank des Lymphsystems werden große oder unlösliche plasmatische Proteinmoleküle, die
normalerweise vom Venensystem nicht wieder absorbiert werden können, erneut in die
Blutzirkulation eingeführt.
Die Moleküle durchlaufen die Kapillarmembran auf eine Weise, die sich negativ proportional zu
ihrem Gewicht verhält: Die Albumin-Menge ist höher in den Lymphen, das ein niedrigeres
Molekulargewicht als Globulin hat. Natürlich führen Schwankungen der kapillaren
Durchlässigkeit, die z. B. durch einen Anstieg des interkapillaren hydrostatischen Drucks oder
toxisch-anoxische Faktoren verursacht werden, zu einem Anstieg dieses Transfers in einer
Modifikation des Lymphflusses oder deren Zusammensetzung.
Zur weiteren Erläuterung fügen wir hier die Erkenntnisse von Rossing hinzu:
1. Die intravaskuläre von Albumin und Immunglobulin hängt vom Umfang der Synthese
und des fraktionierten Katabolismus ab;
2. das Verhältnis zwischen der intravaskulären Masse zur Gesamtmasse richtet sich nach
dem Umfang des transkapillaren Entweichens und dem Umfang des extravaskulären
Rücklaufs;
3. die Menge des transkapillaren Entweichens steht im umgekehrten Verhältnis zum
Molekulargewicht der Proteine; der Umfang des transkapillaren Entweichens erhöht sich
mit dem Filterdruck in den Gefäßen, d. h. mit einem Verlust auf Mikrogefäß-Ebene, wie
es bei Diabetes mellitus erkennbar ist;
4. die Menge des extravaskulären Rücklaufs spiegelt den Lymphprotein-Transport wider
und verhält sich reziprok zur extravaskulären Transitzeit. Es hat die gleiche Magnitude
wie Albumin und lg.G und vielleicht etwas geringer für lg.M;
5. zur extravaskulären Transitzeit gehört eine Reihe von Transitzeiten: kurz (Leber, Nieren,
Lungen), lang (Haut, Muskeln, mit maximaler Ablagerung der extravaskulären Proteine);
6. in den meisten Fällen der Hypoproteinämie verändert sich der Umfang der
intravaskulären/extravaskulären Verteilung des plasmatischen Protein zu Gunsten des
intravaskulären Raums;
7. die pathologische, extravaskuläre Ansammlung des plasmatischen Proteins tritt bei
wenigen Krankheiten und wenn die transkapillare Entweichung ohne einen
entsprechenden Anstieg des Lymphrückflusses ansteigt. Dies ist bei einer Zirrhose mit
Aszites, bei einem unbehandelten Myxödem und bei einigen Krebsarten - insbesondere
in Verbindung mit Hepatopathie und Aszites - erkennbar. Eine extravaskuläre
Ansammlung des plasmatischen Proteins tritt im tumoralen und postoperativen Gewebe
in den Wunden auf.

7
Die Hauptaufgabe des Lymphsystems ist daher, das Eindringen der zuvor erwähnten Moleküle
zu ermöglichen, ein Entweichen zu verhindern und die Progression zu fördern.
Auf Grund der Kapillarfilterung sind Proteinmoleküle und Wasser ausreichend in der
Blutzirkulation vorhanden und führen daher zu einer Ansammlung der Flüssigkeiten, die
osmotisch mit dem Protein im Interstitialgewebe verbunden sind.
Die Flüssigkeit führt zu einer Imbibition des Gewebes, wobei die Endothelialzellen der Lymphe
ausgedehnt und die interendothelialen Verbindungen weiter geöffnet werden.
Sonstige Bewegungen greifen ein, indem sie die Verbindungen "offen halten":
• Muskelbewegungen;
• rhythmische Kontraktionen der Arteriengefäße
• der negative Druck im Thorax;
• die Zellen und sonstige elementare Körperchen, die durch die offenen Verbindungen in den
ersten Lymphgefäßen gedrückt werden.
Während dieses Transits agieren die Körperchen wie Dilatoren und halten den Durchgang
durch die Verbindung des Kapillarhohlraums frei. In den besonders aktiven Bereichen des
Körpers erhöhen die Produkte des Zellstoffwechsels den Blutfluss und die kapillare
Durchlässigkeit, so dass die im Interstitialgewebe enthaltene Flüssigkeit weiter ansteigt und
deren Druck die Eingangskanäle zu den Lymphkapillaren frei hält.
An diese anfängliche Phase schließt sich ein durch Muskelkontraktionen verursachter Anstieg
des lokalen Gewebedrucks an, der die ersten Lymphgefäße komprimiert und somit die Lymphe
in die Nähe der interzellulären Verbindungen drückt. In dieser Phase breitet sich eine bestimmte
Wassermenge von den Lymphgefäßen aus, und die Lymphdrüsen selbst erreichen eine höhere
Konzentration als die Interstitialflüssigkeit.
Durch die höhere Kompression wird das System von den Fibrillen, die sich am Lymphendothel
befinden, gelöst. Die Lymphgefäße, die auf diese Weise komprimiert wurden, werden
offensichtlich kleiner mit geringeren Durchmessern, da sie adhäsive Endothelzellen sind und
daher die hermetisch geschlossenen Verbindungen überlappen.
An diesem Punkt beginnt die dritte Phase: Eine weitere Kompression der ersten Lymphgefäße
drückt die Lymphflüssigkeit durch das erste Ventil. Der plötzliche Druckabfall bedeutet, dass
sich die Lymphgefäße erneut ausdehnen und sich die interzellulären Verbindungen erneut
öffnen.
Dieser Mechanismus wird als "lymphatische Pumpe nach CASLEY-SMITH" bezeichnet.
Interzelluläre lymphatische Verbindungen wurden als "Ansaugventile" bezeichnet, während das
erste lymphatische Ventil als das "Ventil" bekannt ist.
Die ersten Lymphgefäße enthalten mehrere Ansaug- und Druckpumpen, die nicht nur eine rein
mechanische Aufgabe haben, sondern sich auch an unterschiedliche Anforderungen anpassen
können.
2.1.3 Bedeutung des Drucks zwischen Lymph- und Geweberaum
Mc Master ermittelte sowohl von den Lymphkapillaren als auch vom interstitialen Raum die
Druckwerte:
• Druck der Lymphkapillare = 0,7 +/- 0,3 cm. H2O.
• Druck der Lymphkapillare = 1,9 +/- 0,5 cm. H2O.
Dieser Druckunterschied erklärt die Richtung des Flüssigkeitsflusses und der Proteinmoleküle
der Blutkapillare zum interstitialen Gewebe und vom interstitialen Gewebe zu den
Lymphkapillaren.

8
Die daraus resultierende Differenz (0,3 +/- 0,5 cm. H2O) zeigt deutlich, wie groß der
Druckunterschied sein muss, um die Lymphe zu aktivieren. Unter pathologischen Bedingungen
wird diese Differenz höher sein, wenn ein Anstieg des Iinterstitialdrucks vorliegt. Dies erklärt die
gesteigerte Produktion der Lymphe bei Vorhandensein eines Ödems. Die Schwankung des
Absorptionspotenzials ist auch an der Grenzzone zwischen der Basissubstanz und den
Lympkapillaren von großer Bedeutung.
Die Förderung der Lymphe ist daher hauptsächlich auf den Anstieg zurückzuführen, der
zwischen einer Zone des höheren Drucks und einer Zone mit niedrigem Druck erzeugt wird. Für
den gesamten Lymphzyklus tragen viele andere Mechanismen zu einem Anstieg der Lymphe
bei, denen größere oder geringere Bedeutung zugeordnet werden muss (gemäß obiger
Beschreibung). Hierzu gehören die Strukturen der Lymphgefäßwände und der Richtungsventile,
die auch Antigravitations-Mechanismen sind (mit den Lymphknoten).
Die Progressionsgeschwindigkeit der Lymphe schwankt erheblich zwischen den einzelnen
Zonen, der funktionellen Situation und bedingt durch die Tatsache, dass der normale Fluss
durch Blockaden eingeschränkt wird.
2.2 Indikationen
• Thromboembolie Prophylaxe
• Postthrombotische Syndrome
• Ulcus Cruris
• Venöse Ödeme
• Posttraumatische Ödeme
• Geringfügiges Lymphödema
• Lipödeme
• Ödem-Mischformen
• Periphere arterielle Verschlusskrankheit unter strenger Beobachtung
• Sensorische Störung, verursacht durch Hemiplegie
2.3 Kontraindikationen
• Dekompensierte Herzinsuffizienz
• Extensive Thrombophlebitis, Thrombosen oder vermutete Thrombose-Wunderysipel
• gravierende, instabile Hypertonie
• Akutes Weichteiltrauma der Extremitäten
• Neuropathisch verschließende Prozesse im Bereich der Lymphdrainage
3 Allgemein
Die von Enraf-Nonius BV. mit Hilfe der modernsten Technik entwickelten und hergestellten
Geräte entsprechen den strengsten Qualitätsanforderungen und den aktuellen Richtlinien und
Normen.
Das Design, die einfache Bedienung und Funktion sowie die Sicherheit des Gerätes standen
bei der Entwicklung dieses Gerätes im Vordergrund und haben ein modernes, kompaktes Gerät
entstehen lassen, das sich durch eine extrem logische BetriebsStufe - ergänzt durch ein
deutlich lesbares Bildschirm - auszeichnet. Zahlreiche therapeutische Anwendungen
garantieren die Sicherheit des Patienten und des Therapeuten und demonstrieren die höchste
Qualität des Endopress 442.

9
4 Einrichtung
4.1 Auspacken
Endopress 442 ist speziell für den Transport in einem einzelnen Paket mit speziellem
Füllmaterial verpackt, das speziell für die Sicherheit beim Transport und bei der Lagerung
konzipiert wurde.
Um das Gerät aus der Verpackung zu entfernen, stellen Sie das Paket auf eine flache und
waagerechte Oberfläche. Öffnen Sie die Oberseite des Kartons und entfernen Sie das
Füllmaterial aus Polystyrol.
Seien Sie vorsichtig, wenn Sie den Inhalt des Pakets herausnehmen.
Überprüfen Sie den Inhalt des Pakets auf Vollständigkeit. Sollten einzelne Teile fehlen, wenden
Sie sich an Ihren autorisierten Händler von Enraf-Nonius BV.
4.1.1 Standardzubehör:
1442.911 Endopress 442 – 230V GS,
ohne Manschetten
1442.912 Endopress 442 – 115V GS,
ohne Manschetten
1442.810 Attrappenblock 1442.810 Attrappenblock
1442.751 Benutzerhandbuch, Englisch 1442.751 Benutzerhandbuch, Englisch
3444.298 EUR - Stromkabel 3444.611 UL-CSA - Stromkabel
4.1.2 Optionales Zubehör:
Modell
1442.800 Aus neun Segmenten bestehende Manschette für
die unteren Gliedmaßen
1442.801 Arm-Manschette, bestehend aus sieben
Segmenten
Bewahren Sie die Originalverpackung und das gesamte Verpackungsmaterial auf, falls eine
Rücksendung an Ihren Händler erforderlich ist.
4.1.3 Umgebungsbedingungen für den Normalbetrieb
Die Einrichtung des Geräts ist schnell und einfach und erfordert keine besondere
Aufmerksamkeit. Die folgenden Umgebungsbedingungen sind bei der Vorbereitung des
Gerätes ideal:
Raumtemperatur : 10°C bis 40°C
Luftfeuchtigkeit : 10% bis 80% nicht kondensierend
Atmosphärischer Druck : 500 bis 1060 hPa
Vermeiden Sie direkte Sonneneinstrahlung sowie Erschütterungen und den Kontakt mit
chemischen Produkten.
VORSICHT:
Der Endopress 442 sollte nicht verwendet werden, wenn das Risiko besteht, dass externe oder
interne Teile des Gerätes feucht werden können.
4.2 Elektrischer Anschluss
Das Netzteil befindet sich auf der Rückseite des Gerätes und besteht aus einer dreipoligen
Buchse für das Stromkabel, einem herausziehbaren Sicherungskasten mit zwei Sicherungen (s.
Technische Daten) und dem Hauptschalter.
Schließen Sie den dreipoligen Stecker des Stromkabels korrekt an das Netzteil an, das mit dem
Strommodul verbunden wurde.

10
WARNUNGEN:
• Vergewissern Sie sich vor dem Anschließen des Stromkabels an die Steckdose, dass das
Gerät nicht während des Transports beschädigt wurde und dass die Spannung mit der
angegebenen Spannung des Gerätes (siehe Angaben auf dem Typenschild) übereinstimmt.
• Aus Sicherheitsgründen verfügt das Stromkabel über einen geerdeten Stecker.
• Stellen Sie sicher, dass die Steckdose geerdet wurde.
• Das Gerät darf nur an Steckdosen angeschlossen werden, die den EG-Standardrichtlinien
entsprechen.
• Bei Verwendung eines Verlängerungskabels muss sichergestellt werden, dass dieses Kabel
geerdet ist.
• Die Nichtbeachtung der obigen Anweisungen kann eine gefährliche elektrische Entladung
zur Folge haben und eine potenzielle Gefahr für Personen und die Funktion der Maschine
darstellen.
5 Gebrauchsanleitung
Das Gerät Endopress 442 verfügt über eine optimale Systemsteuerung.
Alle Betriebsparameter werden in Echtzeit von einer hochentwickelten elektronischen
Mikroprozessor-Schaltung gesteuert, das die Funktion zusammen mit akustischen Signalen
deutlich anzeigt.
5.1 Betriebsinformationen
Dieses Kapitel enthält wichtige Informationen und Anweisungen zur korrekten Nutzung des
Geräts Endopress 442.
Alle Regelfunktionen sowie die Maschine an sich werden von einem Mikroprozessor gesteuert
und koordiniert. Abgesehen von der Bereitstellung der vorgespeicherten
Anwendungsprogramme stellt der Mikroprozessor sicher, dass die Maschine personalisiert und
auf äußerst sichere und effiziente Weise betrieben werden kann. Über die Schnittstelle kann
der Bediener mit Hilfe eines großen und deutlichen FlüssigkristallBildschirms (LCD) mit
Hintergrundbeleuchtung mit dem Gerät kommunizieren: Alle für den Betrieb benötigten
Informationen sowie der Arbeitsstatus während des Betriebs sowie eventuelle Fehler werden
visuell dargestellt. Die folgenden Abschnitte beschreiben die durchzuführenden Verfahren
sowie die technischen Spezifikationen des Endopress 442. Sie beschäftigen sich außerdem mit
den verschiedenen Optionen, die bei der Auswahl der vorprogrammierten Protokolle für
bestimmte Behandlungen zur Verfügung stehen, sowie mit der Feststellung der korrekten
Arbeitsparameter für die "personalisierte" Anwendung.
5.2 Bedienteile an der Vorderseite
Die Vorderseite des Gerätes, an der sich die Steuerungen und die Signale befinden, ist in Abb.
1 mit den entsprechenden Kennzeichnungen dargestellt.
[1] Auswahltaste 1
[2] Auswahltaste 2
[3] Auswahltaste 3
[4] Auswahltaste 4
[5] Bildschirm
[6] Start-Taste
[7] Stopp-Taste
[8] Bestätigungs-Taste
[9] Zentraler Regler
1
23
4
6
8
7
9
5

11
5.3 Bedienteile an der Rückseite
An der Rückseite befinden sich das Stromzufuhrmodul, das aus dem Hauptschalter, dem
Sicherungskasten und der Buchse für das Stromkabel besteht.
[10] Ein-/Aus-Schalter
[11] Manschetten-Steckverbinder 1
[12] Manschetten-Steckverbinder 2
[13] Anschluss Stromkabel
10
11 12
13
5.4 Einschalten des Geräts
• Schließen Sie das Stromkabel an die Buchse [13] an
• Verwenden Sie den Schalter [10], um das Gerät einzuschalten.
• Während das Gerät hochfährt, erscheint das Logo im Bildschirm.
• Drücken Sie eine beliebige Taste, um das Hauptmenü zu aktivieren.
5.5 Hauptmenü
1z
ENDOPRESS 442
z3
2z Programmwahl Einstellungen z4

12
5.6 Installation und Standardeinstellung
5.6.1 Standardeinstellungen
Hier können die Grundeinstellungen im Speicher des Gerätes gespeichert werden. Sie werden
dann bei jedem Einschalten des Gerätes automatisch angezeigt.
5.6.1.1 Sprache auswählen
1z
ENDOPRESS 442
z3
2z Programmwahl Einstellungen z4
• Wählen Sie "Einstellungen" mit Hilfe der Drucktasten [4]
1z
Bildschirm
Sonstigen
Sprache
Version: 1.00.00
z3
2z Zuruck / z4
• Wählen Sie die Sprachfunktion mit dem zentralen Regler [9] aus
• Bestätigen Sie Ihre Auswahl durch Drücken auf die Bestätigungs-Taste [8].
1z
z3
2z
Italiano
English
Français
Español
Nederlands
Deutsch
Abbrechen / z4
• Wählen Sie die gewünschte Sprache mit dem zentralen Regler [9] aus
• Aktivieren Sie die Sprache durch Drücken auf die Bestätigungs-Taste [8].

13
5.6.1.2 Anzeigeeinstellungen
1z
Bildschirm
Sonstigen
Sprache
Version: 1.00.00
z3
2z Zuruck / z4
• Wählen Sie das Bildschirm mit dem zentralen Regler [9] aus und bestätigen Sie die Eingabe
dann mit der Bestätigungstaste [8].
1z
Kontrast : 30
Helligkeit : 30
Negativ : AUS
z3
2z --
Speichern Zuruck / z4
• Wählen Sie mit dem zentralen Regler [9] eine Option aus der Liste aus
• Ändern Sie die Einstellung mit dem zentralen Regler [9]
• Aktivieren Sie Ihre Auswahl durch Drücken auf die Bestätigungs-Taste [8].
• Drücken Sie die Taste Speichern [1], um die Einstellung zu speichern
• Drücken Sie die Taste Zuruck [4], um zum Hauptmenü zurückzukehren
5.6.1.3 Verschiedene Einstellungen
1z
ENDOPRESS 442
z3
2z Programmwahl Einstellungen z4
• Wählen Sie "Einstellungen" mit Hilfe der Drucktasten [4]
1z
Bildschirm
Sonstigen
Sprache
Version: 1.00.00
z3
2z Zuruck / z4
• Wählen Sie Sonstigen mit dem zentralen Regler [9] aus
• Bestätigen Sie Ihre Auswahl durch Drücken auf die Bestätigungs-Taste [8].

14
1z
Signalton : EIN
Tonhohe : 1
Frei Speicherpl. : 98%
Loschen
z3
2z Speichern Zuruck / z4
• Wählen Sie mit dem zentralen Regler [9] eine Option aus und folgen Sie den Anweisungen
auf dem Bildschirm.
o Signalton: bei jedem Tastendruck einen Signalton hinzufügen.
o Tonhohe: Wählen Sie hier die Tonfrequenz des Signaltons aus
o Freier Speicherplatz: Liefert Informationen über den verfügbaren Speicherplatz
o Loschen: Hier können Sie den gesamten Loschen.
VORSICHT:
o Es werden alle Programme sofort gelöscht: Durch das Formatieren des Systems
ist es nicht möglich, nur eine einzelne Programmposition zu löschen.
o Die vorprogrammierten Protokolle können nicht gelöscht werden.
• Betätigen Sie die Taste Speichern [2], um die Einstellungen zu speichern und zum
vorherigen Menü zurückzukehren.
• Zum Zuruck die Taste [4] betätigen
5.7 Erste Schritte
5.7.1 Ein Programm auswählen
Es gibt mehrere Programme für Bein- und Armmanschetten. Siehe Anhang 1
1z
ENDOPRESS 442
z3
2z Programmwahl Einstellungen z4
• Drücken Sie die Taste [2], um das Menü Programmwahl zu öffnen.
• In diesem Menü können Sie Folgendes auswählen:
o Vorprogrammierte Protokollen. Detaillierte Informationen siehe Anhang 1.
o Die persönlichen Programme via Benutzerspeicher
01 THROMBOEMBOLIE PROPHYLAXE
02 POSTTHROMBOTISCHE SYNDROME
03 ULCUS CRURIS
04 VENÖSE ÖDEME
1z Protokollen z3
2z --
Benutzerspeicher Zuruck / z4
• Wählen Sie ein Protokoll mit dem zentralen Regler [9] aus
• Drücken Sie auf die Bestätigungs-Taste [8], um das Protokoll auszuwählen
• Passen Sie den Druck in der Manschette an (siehe Abschnitt 5.8)

15
01 THROMBOEMBOLIE PROPHYLAXE
Zeit: 25 min Vorbetrachtung
1z Andern Speichern
z3
2z Druck Zuruck / z4
• Drücken Sie die grüne Start-Taste [6], um die Behandlung zu starten, oder ändern Sie die
Behandlungszeit mit Hilfe der Modifikations-Taste.
01 THROMBOEMBOLIE PROPHYLAXE
Zeit: 25 min
1z z3
2z Druck z4
5.8 Druck-Einstellungen
Der Endopress 442 garantiert die maximale Kontrolle des angewandten Drucks. Es ermöglicht
dem Bediener, für jede einzelne Zelle unterschiedliche Maximaldruckwerte einzustellen, oder
die Einstellung "Gesamt" zu verwenden, um für alle Segmente den gleichen Wert vorzugeben.
Diese Werte werden vom Bediener nach Überprüfung des Krankengeschichte des Patienten
und Durchführung einer objektiven Analyse definiert.
Für die Protokolle gibt es zwei unterschiedliche Druckeinstellungen;
• Beim Anstiegsverfahren ist die Manschette in 3 Zonen aufgeteilt.
o Zone 1 - 100% , Zone 2 - 80%, Zone 3 - 60%
• Beim linearen Verfahren ist der Druck in allen Zellen gleich. (100%)
Anstiegsverfahren Lineares Verfahren

16
5.8.1 Für einen gleichmäßigen Druck in allen Segmenten
• Drücken Sie die Auswahl-Taste [2]
• Drücken Sie auf die Bestätigungs-Taste [8], um den Gesamtdruck zu ändern
• Ändern Sie den Wert mit dem zentralen Regler [9]
• Drücken Sie erneut die Bestätigungstaste [2]
• Drücken Sie auf die Speichern-Taste [2], um die Einstellung zu speichern
01 THROMBOEMBOLIE PROPHYLAXE
Zeit: 25 min Vorbetrachtung
1z Andern Speichern
z3
2z Druck Zuruck / z4
Gesamt: 80 mmHg Druck 5: 80%
Druck 1: 100% Druck 6: 80%
Druck 2: 100% Druck 7: 60%
Druck 3: 100% Druck 8: 60%
1z Druck 4: 80% Druck 9: 60% z3
2z Speichern Abbrechen
/ z4
5.8.2 Individuelle Einstellung pro Segment
• Wählen Sie mit dem zentralen Regler [9] ein Segment aus der Liste aus.
• Drücken Sie die Bestätigungstaste [8]
• Ändern Sie den Wert mit dem zentralen Regler [9]
• Drücken Sie die Bestätigungstaste [8] und wählen Sie mit dem zentralen Regler [9] ein
anderes Segment aus.
• Wiederholen Sie dieses Verfahren für alle anderen Segmente.
• Drücken Sie auf die Speichern-Taste, um die Einstellungen zu speichern
VORSICHT
• Die Drucktherapie muss durch Anwendung der korrekten Druckfelder und ohne
Beeinträchtigung der Physiologie der Arterien-, Venen- oder Lymphzirkulation durchgeführt
werden (aus diesem Grund sind die Arme und Beine in einer Art Fischgrätenmuster mit
teilweise überlappenden Abschnitten konstruiert). Die maximale Intensität des Drucks, der
auf den Patienten ausgeübt wird, ist ebenfalls ein wichtiger Parameter. In bestimmten Fällen
muss dieser Wert sehr niedrig gehalten werden (zum Beispiel, wenn die Drucktheraphie zur
physiologischen Massage bei den Patienten verwendet wird, bei denen andere Formen der
aktiven oder passiven Bewegung undurchführbar sind. Der Wert kann bei anderen
Anwendungen - z. B. bei Anit-Cellulite-Anwendungen - höher sein.
• Der Endopress kann einen maximalen Druck von 150 mmHg pro Segment bereitstellen. Die
Behandlungen werden normalerweise mit einem Druck zwischen 40 und 80 mmHg
durchgeführt. Ein höherer Druck kann nur in bestimmten Fällen und unter strenger ärztlicher
Aufsicht verwendet werden.
• Der Bediener sollte den angewandten Druck begrenzen, um eine Beeinträchtigung des
Arterienflusses zu vermeiden.

17
5.8.2.1 Pause – Die Behandlung beenden
• Drücken Sie während der Behandlung die Stopp-Taste [7] um das Programm zu
unterbrechen
• Drücken Sie die grüne Start-Taste [6], um die Behandlung fortzusetzen
01 THROMBOEMBOLIE PROPHYLAXE
PROGRAMM IST
UNTERBROCHEN
1z
z3
2z Druckeinstel. z4
• Drücken Sie erneut die Stopp-Taste, um die Behandlung zu stoppen und den Druckabfall
der Manschette zu unterbinden.
• Drücken Sie erneut die Stopp-Taste, um die Behandlung zu stoppen und den Druckabfall
der Manschette zu unterbinden.
01 THROMBOEMBOLIE PROPHYLAXE
PROGRAMM
IST BEENDET
1z
z3
2z Druckeinstel. z4
5.8.2.2 Behandlungszeit ändern
01 THROMBOEMBOLIE PROPHYLAXE
Zeit: 25 min Vorbetrachtung
1z Andern Speichern
z3
2z Druck 80 mmHg Zuruck / z4
• Drücken Sie die Ändern-Taste [1] und wählen Sie „Zeit“ mit dem zentralen Regler [9] aus.
• Bestätigen Sie die Auswahl mit der Bestätigungs-Taste [8] und ändern Sie die Zeit mit Hilfe
des zentralen Reglers [9]. Bestätigen Sie Ihre Auswahl durch Drücken auf die Bestätigungs-
Taste [8].

18
5.8.2.3 Programm-Vorbetrachtung
01 THROMBOEMBOLIE PROPHYLAXE
Zeit: 25 min Preview
1z Andern Speichern
z3
2z Druck 80 mmHg Zuruck / z4
• Drücken Sie die Ändern-Taste [1] und wählen Sie „Vorbetrachtung“ mit dem zentralen
Regler [9] aus.
• Bestätigen Sie Ihre Auswahl durch Drücken auf die Bestätigungstaste [8]
• Drücken Sie die Taste Zuruck [6], um zur vorherigen Ansicht zurückzukehren.
5.8.3 Ein persönliches Programm Schritt für Schritt anlegen
Das Endopress-Gerät bietet 50 Programmierungspositionen, mit denen Sie eigene Programme
erstellen können.
Die neuen Programme finden Sie unter "Benutzer-Speicher".
1z
ENDOPRESS 442
z3
2z Programmwahl Einstellungen z4
• Wählen Sie mit Hilfe der Taste [2] die Option "Programmwahl" im Hauptmenü aus
PETER PETERSON
1z Protokollen z3
2z Benutzerspeicher Zuruck / z4
• Wählen Sie mit dem zentralen Regler [9] ein Programm aus der Liste aus.
• Wählen Sie die Option durch Drücken auf die Bestätigungs-Taste [8] aus
01 THROMBOEMBOLIE PROPHYLAXE
Zeit: 25 min Vorbetrachtung
1z Andern Speichern
z3
2z Druck 80 mmHg Zuruck / z4
• Drücken Sie die Ändern-Taste [1] und wählen Sie „Zeit“ mit dem zentralen Regler [9] aus.
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
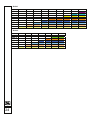 26
26
Enraf-Nonius Endopress 442 Benutzerhandbuch
- Typ
- Benutzerhandbuch
Verwandte Papiere
-
Enraf-Nonius Endopress 442 Benutzerhandbuch
-
Enraf-Nonius Endopress 442 Benutzerhandbuch
-
Enraf-Nonius Endolaser 422 Benutzerhandbuch
-
Enraf-Nonius Endolaser 422 Benutzerhandbuch
-
Enraf-Nonius Endolaser 422 Benutzerhandbuch
-
Enraf-Nonius Endolaser 422 Benutzerhandbuch
-
Enraf-Nonius CD-ROM Endomed 484 Benutzerhandbuch
-
Enraf Nonius Curapuls 670 Benutzerhandbuch


























