3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Bedienungsanleitung
- Typ
- Bedienungsanleitung

Product Instructions
DPQCOG3000/3060
3
EN
Microbial Luminescence System Ultra High Temperature Dairy Screen Kit
FR
Microbial Luminescence System kit pour les laitages ultra haute température
DE
Mikrobielles Lumineszenz System Ultrahochtemperatur Molkereiprodukte Screening Kit
IT
Kit di controllo per prodotti caseari trattati a temperatura elevatissima per sistemi di
luminescenza microbica
ES
Sistema de Luminiscencia para Detección Microbiana Kit de Análisis para Productos
Lácteos Ultra Alta Temperatura
NL
Kit voor het screenen van UHT-zuivelproducten op basis van een microbieel
luminescentiesysteem
SV
Mikrobiellt belysningssystem ultrahög temperatur mejeritestsats
DA
Mikrobielt Luminescenssystem Ultrahøj Temperatur Mælkeprodukter Screeningsæt
NO
Mikrobielt luminescenssystem screeningkit for ultrapasteuriserte meieriprodukter
FI
Mikrobiluminesenssijärjestelmän äärimmäisen korkeissa lämpötiloissa käytettävä
maitotuotteiden tarkastussarja
PT
Kit de Análise de Laticínios em Temperatura Ultraelevada para Sistema de
Luminescência Microbiana
EL
Κιτ Ελέγχου Γαλακτοκομικών Εξαιρετικά Υψηλής Θερμοκρασίας Συστήματος
Μικροβιακής Φωτοανίχνευσης
PL
Zestaw do badań przesiewowych nabiału UHT do systemu luminescencji
mikrobiologicznej (MLS)
HU
Ultramagas hőmérsékleten hőkezelt tejtermékek vizsgálatára szolgáló mikrobiológiai
lumineszcencia rendszer kit
CS
Vyšetřovací sada s mikrobiálním luminiscenčním systémem pro mléčné výrobky
ošetřené ultra vysokou teplotou
RO
Set pentru analiza produselor lactate cu temperatură ultra-ridicată cu sistem
deluminiscenă microbiană
RU
Комплект для скрининга молочных продуктов, прошедших
ультравысокотемпературную обработку, в составе микробиологической
люминисцентной системы
TR
Mkrobyal Lümnesans Sstem Ultra Yüksek Sıcaklık Süt Ürünler Tarama Kt
JA
微生物発光検出システム UHT 乳製品用スクリーンキット
ZH
微生物发光系统超高温乳制品筛选试剂盒
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...

(Deutsch)
DE
1
Erscheinungsdatum: 2018-09
Gebrauchsanweisungen
Mikrobielles Lumineszenz System Ultrahochtemperatur
Molkereiprodukte Screening Kit
Produktbeschreibung und Verwendungszweck
Das 3M™ Mikrobielle Lumineszenz System (MLS) Ultrahochtemperatur (UHT) Molkereiprodukte Screening Kit
ist für die Verwendung mit dem 3M™ Mikrobiellen Lumineszenz System (MLS) II Gerät vorgesehen. Dieses Kit
beinhaltet ein schnelles Detektionssystem, das mithilfe der Adenosintriphosphat-(ATP-)Biolumineszenz-Technologie
mikrobielles ATP in Molkerei- und Molkereiersatzprodukten nachweisen kann, die für die kommerzielle Sterilisation,
einschließlich ultrahocherhitzte (UHT) und haltbarkeitsverlängerte (ESL) Produkte, verarbeitet wurden. Nachdem das
Produkt in seiner ungeöneten Originalverpackung einem Anreicherungsschritt unterzogen wurde, verfügt das 3M
MLS UHT Molkereiprodukte Screening Kit über die Möglichkeit, ATP aus nicht mikrobiellen Quellen auszuschließen
und anschließend lediglich das von den Mikroorganismen freigesetzte ATP zu messen. In weniger als 30Minuten
wird das mikrobielle ATP in einem Lichtausgabeformat aus relativen Lichteinheiten (RLU) proportional zu dem in der
angereicherten Probe vorhandenen mikrobiellen ATP gemessen. Das 3M MLS UHT Molkereiprodukte Screening Kit
führt im Vergleich zu herkömmlichen mikrobiologischen Testmethoden zu einer deutlich früheren Produktfreigabe.
3M Food Safety hat für die Bereiche Entwicklung und Fertigung die Zertizierung ISO9001 der Internationalen
Organisation für Normung (ISO) erhalten.
Sicherheit
Der Anwender sollte alle Sicherheitshinweise in den Anweisungen zum 3M MLS UHT Molkereiprodukte Screening Kit
lesen, verstehen und befolgen. Bewahren Sie diese Sicherheitshinweise auf, um später auf sie zurückgreifen zu können.
HINWEIS: Bezeichnet eine potenzielle Gefahrensituation, die– wenn sie nicht vermieden wird– zu Sachschäden
führen kann.
HINWEIS
Um das Risiko für falsche Ergebnisse zu reduzieren, beachten Sie Folgendes:
• Die dehydrierten ATPase- und die LL1-Reagenzien sowie die entsprechenden Puer sollten bei 2-8°C gelagert
werden.
• Die Reagenzien des Kits vor direkter Sonneneinstrahlung schützen.
• Das rekonstituierte ATPase nicht nach dem 2. Tag und das rekonstituierte LL1 nicht nach dem 5. Tag verwenden,
wenn bei 2-8°C gelagert.
• Das rekonstituierte ATPase am 2. Tag und das rekonstituierte LL1 am 5. Tag der Haltbarkeit nicht länger als12
Stunden Umgebungstemperaturen (20 bis 25°C) aussetzen.
• Rekonstituierte Reagenzien nicht schütteln. Gebrauchsanweisung in Bezug auf die Reagenzvorbereitung befolgen.
Zur Verminderung des Risikos, die mit der Exposition gegenüber Chemikalien und biogefährlichen Stoen
verbunden sind:
• Angereicherte Proben in Übereinstimmung mit den üblichen Labor-Sicherheitsmaßnahmen handhaben und
entsprechende Schutzkleidung und Augenschutz tragen.
Zur Verminderung von Kreuzkontaminationsrisiken bei der Vorbereitung des Tests:
• Das Tragen von Handschuhen wird empfohlen.
• ATP ist eine häug vorkommende Substanz. Es ist auf Haut, Haar und zahlreichen Oberächen vorhanden. Um eine
ATP-Kontamination zu vermeiden, weder die Pipettenspitzen oder Stopfen der Reagenzäschchen noch einen Teil
des 3M MLS II Geräts mit bloßen Händen berühren, der in direkten Kontakt mit den Reagenzien kommt.
Weitere Informationen sind dem Sicherheitsdatenblatt zu entnehmen.
Wenn Sie Informationen über ein bestimmtes Produkt wünschen, besuchen Sie unsere Website auf
www.3M.com/foodsafety oder wenden Sie sich an den lokalen 3M-Verkaufsvertreter oder Händler.
3

(Deutsch)
DE
2
Verantwortung des Anwenders
Anwender müssen sich auf eigene Verantwortung mit den Gebrauchsanweisungen und Informationen des Produkts
vertraut machen. Für weitere Informationen besuchen Sie unsere Website unter www.3M.com/foodsafety oder
wenden Sie sich an Ihren lokalen 3M Verkaufsvertreter oder Händler.
Bei der Auswahl einer Testmethode ist zu beachten, dass externe Faktoren wie Probennahme, Testprotokoll,
Probenaufbereitung, Handhabung und Labortechnik die Ergebnisse beeinussen können. Die Lebensmittelprobe selbst
kann die Ergebnisse beeinussen.
Es liegt in der Verantwortung des Anwenders bei der Auswahl einer Testmethode oder eines Produkts, diese mit einer
ausreichenden Anzahl von Proben und Kontrollen zu evaluieren, um sicherzustellen, dass die gewählte Testmethode
seinen Anforderungen entspricht.
Der Anwender trägt ebenfalls die Verantwortung dafür, dass die angewendeten Testmethoden und Ergebnisse den
Anforderungen seiner Kunden und Lieferanten entsprechen.
Wie bei allen Testmethoden, stellen die mit 3M Lebensmittelsicherheitsprodukten erhaltenen Ergebnisse keine Garantie
für die Qualität der untersuchten Matrizen oder Prozesse dar.
Haftungsbeschränkungen / Beschränkte Rechtsmittel
AUSSER ES WIRD AUSDRÜCKLICH ANDERS IM ABSCHNITT DER HAFTUNGSBESCHRÄNKUNGEN DER VER-
PACKUNG DES JEWEILIGEN PRODUKTS ANGEGEBEN, LEHNT 3M ALLE AUSDRÜCKLICHEN UND STILL-
SCHWEIGENDEN GARANTIEN, EINSCHLIESSLICH, JEDOCH NICHT BESCHRÄNKT AUF, DIE GEWÄHRLEISTUNG
DER MARKTGÄNGIGKEIT ODER DER EIGNUNG FÜR EINEN BESTIMMTEN ZWECK AB. Sollte sich ein Produkt von
3MFood Safety als defekt herausstellen, wird es von 3M oder einem autorisierten Vertragshändler nach eigenem
Ermessen ersetzt oder der Kaufpreis zurückerstattet. Gewährleistungsansprüche bestehen nicht. Sie sind verpichtet,
3Mumgehend innerhalb von sechzig Tagen, nachdem die mutmaßlichen Defekte am Produkt festgestellt wurden, davon
zu informieren und das Produkt an 3M zurückzusenden. Bitte rufen Sie dazu den Kundenservice (1-800-328-1671
in den USA) oder Ihren autorisierten Vertreter für 3M Lebensmittelsicherheit an und sprechen Sie mit ihm über die
Rücksendung der Ware.
Haftungsbeschränkungen von 3M
3M HAFTET NICHT FÜR VERLUSTE ODER SCHÄDEN, GANZ GLEICH OB MITTELBARE, UNMITTELBARE, SPEZIELLE,
NEBEN- ODER FOLGESCHÄDEN EINSCHLIESSLICH, ABER NICHT BESCHRÄNKT AUF ENTGANGENEN GEWINN. In
keinem Fall übersteigt die Haftung von 3M den Kaufpreis des angeblich defekten Produkts.
Lagerung und Entsorgung
Tabelle 1 enthält Informationen zu den Lagerungsbedingungen. NICHT EINFRIEREN.
Komponenten des 3M MLS UHT Molkereiprodukte Screening Kits dürfen nicht nach ihrem Haltbarkeitsdatum verwen-
det werden. Das Verfalldatum und die Chargennummer sind auf dem äußeren Etikett der Packung angegeben.
Gemäß den aktuellen lokalen/regionalen/nationalen/industriellen Standards und Richtlinien entsorgen.
Tabelle1. Kit-Inhalt für 3060 (Das DPQCOG3000 enthält fünf 3060 Kits).*
Artikel Beschreibung Stückzahl Lagerung Kommentare
ATPase**
(blaue Kappe)
Gereinigtes, lyophilisiertes
ATPase-Enzym, das
somatische Zellen und freies
ATP für den Nachweis von
mikrobiellem ATP abbaut
4 Fläschchen mit
lyophilisiertem
Enzym
2 - 8°C
NICHT
EINFRIEREN
Mit ATPase-Puer
rekonstituieren (nachstehende
Anweisungen lesen)
ATPase-Puer
(orange Kappe)
Puer für die Rekonstitution
des ATPase-Enzyms
4Fläschchen 2 - 8°C
NICHT
EINFRIEREN
Wird für die Rekonstitution
des lyophilisierten ATPase-
Enzyms verwendet
(nachstehende Anweisungen
lesen)
Extraktionsmittel
(schwarze
Kappe)
Schnelle Lysis von
Mikroorganismen für
die Freisetzung von
mikrobiellemATP
1Flasche 20 bis 25°C
NICHT
EINFRIEREN
Gebrauchsfertig
HINWEIS: Bis zur ersten
Verwendung kühl lagern.
Nach Anbruch bei 20 - 25°C
lagern. Im Dunkeln lagern.

(Deutsch)
DE
3
LL1**
(grüne Kappe)
Gereinigter Luciferin-
Luciferase-Komplex, der mit
mikrobiellem ATP interagiert,
um Licht zu produzieren, das
vom 3M MLS II Gerät erfasst
wurde
2 Fläschchen mit
lyophilisiertem
Enzym
2 - 8°C
NICHT
EINFRIEREN
Mit LL1-Puer rekonstituieren
(nachstehende Anweisungen
lesen)
LL1-Puer
(orange Kappe)
Puer für die Rekonstitution
des LL1-Enzyms
2Fläschchen 2 - 8°C
NICHT
EINFRIEREN
Wird für die Rekonstitution
des lyophilisierten LL1-Enzyms
verwendet (nachstehende
Anweisungen lesen)
* HINWEIS: 3060 und DPQCOG3000 können für die Durchführung von bis zu 600 bzw. 3.000 Tests verwendet
werden. Ein Fläschchen mit LL1 und ATPase mit dem entsprechenden Puer rekonstituieren, um bis zu 300 bzw.
150Tests durchzuführen.
** Die Markierungen von 50 bis 300 links vom Etikett sind eine Schätzung der im Fläschchen verbleibenden Proben.
In der nachfolgenden Tabelle sind Zubehörprodukte für das 3M MLS II aufgeführt, die nicht im 3M MLS UHT
Molkereiprodukte Screening Kit enthalten sind.
Tabelle2. 3M Mikrobielles Lumineszenz System (MLS) II Produkte.
Artikelnummer Beschreibung
ATP10 3M™ Clean-Trace™ positive Oberächenkontrolle (ATP10)
3004 3M™ Mikrobielles Lumineszenz System (MLS) ATP Reagenz Kontrolle
3005 3M™ Mikrobielles Lumineszenz System (MLS) Injektor Reinigung Kit
3006 3M™ Mikrobielles Lumineszenz System (MLS) Wartungslösung
3007 3M™ Mikrobielles Lumineszenz System (MLS) Platte mit Mikrovertiefungen
3008 3M™ Mikrobielles Lumineszenz System (MLS) Streifen mit Mikrovertiefungen
3009 3M™ Mikrobielles Lumineszenz System (MLS) Halter für Streifen mit Mikrovertiefungen
BMLSCK 3M™ Mikrobielles Lumineszenz System (MLS) Kit für wöchentliche Reinigung
Bedienungsanleitung
Befolgen Sie alle Anweisungen genau. Andernfalls werden möglicherweise ungenaue Ergebnisse erzielt.
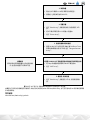
Der gesamte Ablauf aller Verfahren zum 3M MLS UHT Molkereiprodukte Screening Kit wird in Abbildung 1 am Ende
dieses Dokuments beschrieben.
Probenanreicherung
Vor dem Screening von UHT- oder ESL-Molkereiprodukte mit dem 3M MLS UHT Molkereiprodukte Screening Kit
müssen die Proben für das Wachstum geringer Populationen an Mikroorganismen angereichert werden.
1. Das Getränk im Inkubator platzieren. Um eine einheitliche Temperatur innerhalb des Getränkebehälters zu erreichen,
sicherstellen, dass die Behälter sich nicht gegenseitig oder die Wände des Inkubators berühren. Der Anwender
selbst ist für die Validierung des Anreicherungsprotokolls verantwortlich, durch das sichergestellt werden muss,
dass die Ergebnisse den Anwenderanforderungen entsprechen.
2. Den Getränkebehälter nach der Anreicherung aus dem Inkubator nehmen.
3. Anschließend ein Probenscreening mit dem 3M MLS UHT Molkereiprodukte Screening Kit durchführen.
Reagenzvorbereitung
ATPase-Reagenz**
1. Das ATPase-Fläschchen (blaue Kappe) önen, das das lyophilisierte ATPase-Enzym enthält. Den Gummistopfen
vorsichtig abnehmen; Inhalt steht unter Vakuum.
2. Das ATPase-Pueräschchen (orange Kappe) önen und den gesamten Puerinhalt in das ATPase-Fläschchen
geben oder pipettieren.
3. Den Gummistopfen wieder aufsetzen und das Fläschchen 5- bis 10-mal umdrehen, um die lyophilisierte ATPase
aufzulösen. Anschließend vorsichtig kreisen lassen. NICHT SCHÜTTELN.

(Deutsch)
DE
4
**HINWEIS: Das rekonstituierte ATPase weist eine Haltbarkeit von 2Tagen auf, wenn dieses bei 2 bis 8°C gelagert wird
(bis zu 12Stunden bei 20 bis 25°C). Das rekonstituierte ATPase bei 2 bis 8°C lagern, wenn dieses nicht verwendet wird.
Das rekonstituierte ATPase nicht einfrieren.
LL1-Reagenz**
1. Das LL1-Fläschchen (grüne Kappe), das den lyophilisierten Luciferin-Luciferase-Komplex enthält, önen. Den
Gummistopfen vorsichtig abnehmen; Inhalt steht unter Vakuum.
2. Das LL1-Pueräschchen (orange Kappe) önen und den gesamten Puerinhalt in das LL1-Fläschchen geben oder
pipettieren.
3. Den Gummistopfen wieder aufsetzen und das Fläschchen 5-mal umdrehen, um das lyophilisierte LL1 aufzulösen.
Anschließend vorsichtig kreisen lassen. NICHT SCHÜTTELN.
**HINWEIS: Das rekonstituierte LL1 weist eine Haltbarkeit von 5Tagen auf, wenn dieses bei 2 bis 8°C gelagert wird
(bis zu 12Stunden bei 20 bis 25°C). Die rekonstituierten ATPase- und LL1-Reagenzien bei 2 bis 8°C lagern, wenn diese
nicht verwendet werden. Rekonstituierte LL1 nicht einfrieren.
Extraktionsmittel (schwarze Kappe)
Die Extraktionslösung kann umgehend verwendet werden. Nach Anbruch bei 20 bis 25°C lagern. Danach nicht wieder
im Kühlschrank lagern. An einem dunklen Ort lagern.
Vorbereitung des 3M MLS II Geräts
a. Das System für die erste Verwendung reinigen
1. Zuerst das 3M MLS II Gerät und anschließend den Computer einschalten.
2. 3M™ Mikrobielles Lumineszenz System (MLS) II Software starten.
3. Drei Fläschchen mit der 3M MLS Reinigungslösung in den Injektoren des 3M MLS II Geräts platzieren.
4. In der 3M MLS II Software die Registerkarte „Übersicht“ önen und einen „Wash Assay“ durchführen.
5. Die drei Fläschchen mit der 3M MLS Reinigungslösung durch drei Fläschchen mit ATP-freiem Wasser ersetzen und
einen zweiten „Wash Assay“ durchführen.
Ausführliche Informationen zur Reinigung der Injektoren des 3M MLS II Geräts nden Sie im 3M MLS II
Benutzerhandbuch.
b. Füllen der Injektorleitungen des 3M MLS II Geräts mit Reagenzien
Wichtig: Sicherstellen, dass alle Reagenzien (rekonstituiertes ATPase, Extraktionsmittel und rekonstituiertes LL1)
die Umgebungstemperatur (20 bis 25°C) erreicht haben, bevor der Reagenzien Kontroll Assay und der UHT Assay
durchgeführt werden.
1. Fläschchen mit ATP-freiem Wasser durch rekonstituiertes ATPase (an Injektor A), Extraktionsmittel (an Injektor B)
und rekonstituiertes LL1 (an Injektor C) ersetzen. Fläschchen zur späteren Lagerung wieder mit Gummistopfen und
Kappen verschließen.
2. In der 3M MLS II Software die Registerkarte „Übersicht“ önen und einen „Prime Assay“ durchführen.
Ausführlichere Informationen zum Füllen des 3M MLS II Geräts nden Sie im 3M MLS II Benutzerhandbuch.
HINWEIS: Das Füllen der Injektoren vor der Durchführung eines Reagenz Kontroll Assays und eines Molkereiprodukte
Screening Assays ist erforderlich, um sicherzustellen, dass die Injektoren des Geräts und Reagenzäschchen mit den
Reagenzien des 3M MLS UHT Molkereiprodukte Screening Kits vorgefüllt wurden. Ist dies nicht der Fall, kann es zu
falsch-negativen oder falsch-positiven Ergebnissen kommen.
c. Durchführung eines Reagenz Kontroll Assays
Die Durchführung eines Reagenz Kontroll Assays wird stets vor der Produktprüfung empfohlen, um sicherzustellen, dass
das 3M MLS II Gerät ordnungsgemäß funktioniert und die Reagenzien ordnungsgemäß verarbeitet werden. Ausführliche
Informationen zum Reagenz Kontroll Assay und der Rekonstitution der ATP-Reagenz nden Sie in den Anweisungen der
3M MLS ATP Reagenz Kontrolle oder 3M Clean-Trace positive Oberächenkontrolle (ATP10).
1. Einen 3M MLS Streifen mit Mikrovertiefungen (mindestens 6 Vertiefungen) in einem 3M Halter für Streifen mit
Mikrovertiefungen platzieren. Anstelle des 3M MLS Streifens mit Mikrovertiefungen kann eine 3M MLS Platte mit
Mikrovertiefungen verwendet werden.
2. 50l des rekonstituierten ATP-Reagenzes (ATP10 oder 3004 siehe Tabelle 2) auf den Boden der letzten
4Vertiefungen (C1, D1, E1 und F1) pipettieren. Die Vertiefungen A1 und B1 sollten leer sein.

(Deutsch)
DE
5
3. In der 3M MLS II Software die Registerkarte „Übersicht“ önen und einen „Reagent Control Assay“ durchführen.
Ausführlichere Informationen zum Reagenz Kontroll Assay und zur Interpretation der Ergebnisse nden Sie in der
Gebrauchsanweisung der 3M MLS ATP Reagenz Kontrolle oder 3M Clean-Trace positive Oberächenkontrolle (ATP10).
UHT Assay durchführen
1. Das angereicherte Getränk in seiner ungeöneten Originalverpackung durch Schütteln homogenisieren.
2. 50µl des angereicherten Getränks in einem aseptischen Verfahren mit einer Mikropipette entnehmen und die Probe
auf den Boden einer Vertiefung einer 3M MLS Platte mit Mikrovertiefungen pipettieren (bei weniger Assays kann
ein 3M MLS Streifen mit Mikrovertiefungen verwendet werden).
HINWEIS. Zur Gewährleistung korrekter Ergebnisse müssen die Proben pipettiert werden. Wird die Probe an der Wand
der Vertiefung platziert, kann dies zu ungenauen Ergebnissen führen. Die Benutzer sollten die Proben direkt auf den
Boden der Vertiefung pipettieren.
3. Diesen Schritt für jede Probe mit einer neuen Pipette wiederholen. Es wird empfohlen, die Probe in der Reihenfolge
der Reihen von A1 bis H1, von A2 bis H2 usw. zu pipettieren.
4. In der 3M MLS II Software die Registerkarte „Übersicht“ önen und den UHT Assay.V1 auswählen.
5. Gegebenenfalls die Chargeninformationen für das 3M MLS UHT Molkereiprodukte Screening Kit eingeben und auf
„OK“ klicken.
6. Die Vertiefungen auswählen, die die in dem Raster mit 96 Vertiefungen zu analysierenden Proben enthalten, das auf
der Registerkarte „Übersicht“ angezeigt wird (nicht ausgewählte Vertiefungen werden nicht analysiert).
7. Auf „Start“ klicken.
8. Die Informationen unter „Lade Mikroplatte“ eingeben (Dateinamen für Assay eingeben).
9. Vorsichtig die 3M MLS Platte mit Mikrovertiefungen, die die Proben enthält, auf dem Plattenträger des 3M MLS II
Geräts platzieren und dabei sicherstellen, dass Vertiefung „A1“ sich in der linken Ecke des Plattenträgers (möglichst
nahe beim Benutzer) bendet.
10. Auf „OK“ klicken. Der Assay wird gestartet.
11. Nach Beendigung des Assays die 3M MLS Platte mit Mikrovertiefungen aus dem 3M MLS II Gerät entnehmen und
die Platte in Übereinstimmung mit den aktuellen Branchenstandards entsorgen.
Auswertung der Ergebnisse
HINWEIS. Der Anwender ist für die Validierung der Grenzwerte für bestanden/nicht bestanden verantwortlich, um
sicherzustellen, dass diese Testmethode die Anwenderkriterien erfüllt. Zur Bestimmung der Grenzwert-/Hintergrund-
RLU wird empfohlen, wiederholte Messungen (mehrere Replikate) der RLU-Werte von mehreren Chargen nicht konta-
minierter Produkte durchzuführen. Diese Daten für die Bestimmung der Standardabweichung der Hintergrund-RLU
des analysierten Produkts verwenden. Ein Mindestgrenzwert für bestanden/nicht bestanden kann als durchschnittliche
Hintergrund-RLU plus dreimal die Standardabweichung der Hintergrund-RLU für jede(s) spezische(s) Matrix/Produkt
deniert werden. Ausführliche Anweisungen zur Änderung der Grenzwerte für bestanden/nicht bestanden in der
Software erhalten Sie bei Ihrem 3M Kundendienstmitarbeiter.
1. Nach circa 27Minuten werden die Ergebnisse (bei einer vollständigen Platte mit 96 Proben) in der Registerkarte
„Report“ angezeigt. Ein Farbcode zeigt die Ergebnisse (den Fortschritt des Assays) an (grün/bestanden und
rot/nicht bestanden). Wenn der Cursor über die Vertiefung bewegt wird, wird der RLU-Wert in Echtzeit während der
Verarbeitung des Assays angezeigt.
2. Das Ergebnis bestanden oder nicht bestanden wird anhand eines Grenzwertes für bestanden/nicht bestanden
basierend auf einem RLU-Grenzwert bestimmt. Ein Ergebnis von <150RLU gilt in der Software standardmäßig
als bestanden. Allerdings können die Grenzwerte für bestanden/nicht bestanden je nach Kunden- oder Produkt-
anforderungen variieren.

(Deutsch)
DE
6
Reinigung des 3M MLS II Geräts nach der Verwendung
Nach dem Testen der Proben müssen die Abgabeleitungen und Injektoren der Reagenzien gereinigt werden, indem
ATP-freies Wasser durch das System gespült wird.
1. Das ATPase-Fläschchen, Extraktionsmittel und LL1-Fläschchen durch Fläschchen mit ATP-freiem Wasser ersetzen.
Die Fläschchen mit den entsprechenden Gummistopfen/Kappen verschließen und die ATPase- und LL1-Reagenzien
bei 2 bis 8°C lagern oder ordnungsgemäß entsorgen. Extraktionsmittel nach der ersten Verwendung bei
20 bis 25°C lagern (Tabelle 1).
2. Die Registerkarte „Übersicht“ auswählen und auf den „Wash Assay“ mit ATP-freiem Wasser klicken. Anschließend
diesen Schritt mit der 3M MLS Reinigungslösung wiederholen. Die 3M MLS Reinigungslösung bis zur nächsten
Verwendung im Gerät belassen.
Ausführliche Informationen zur Reinigung der Injektoren des 3M MLS II Geräts nden Sie im 3M MLS
Benutzerhandbuch.
HINWEIS. Der Abfallbehälter des 3M MLS II Geräts sollte täglich entleert werden.

(Deutsch)
DE
7
1. Reagenzvorbereitung
A. ATPase- und LL1-Reagenzien dehydrieren
(Extraktionsmittel ist gebrauchsfertig).
B. Vor der Verwendung alle Reagenzien auf
20 bis 25°C erwärmen lassen.
2. Einrichten des Geräts
A. Zuerst einen „Wash Assay“ mit der Reinigungslösung
und anschließend mit ATP-freiem Wasser
durchführen.
B. ATPase, Extraktionsmittel und LL1-Reagenzien im
Gerät platzieren.
C. Einen „Prime Assay“ durchführen.
3. Die Geräte- und Reagenzleistung überprüfen
A. Ein „Reagent Control Assay“ mit 3M MLS ATP
Reagenz Kontrolle (3004) oder 3M Clean-Trace
positive Oberächenkontrolle (ATP10) starten.
4. Mit dem 3M MLS UHT Molkereiprodukte Screening
Kit einen Molkereiprodukte Screening Assay
durchführen
A. 50l der angereicherten Probe in die 3M MLS Platte
mit Mikrovertiefungen übertragen.
B. „UHT Assay“ starten.
Angereicherte Probe
(Das Getränk wurde in seiner
Originalverpackung für eine
entsprechende Dauer und bei
entsprechender Temperatur inkubiert)
5. Gerät nach der Verwendung reinigen
A. Zuerst einen „Wash Assay“ mit ATP-freiem Wasser
und anschließend mit Reinigungslösung durchführen.
Abbildung1. Workow zum Screening von UHT- und ESL-Molkereiprodukten oder Molkereiersatzprodukten.
Sollten Sie Fragen zu bestimmten Anwendungen oder Verfahren haben, besuchen Sie unsere Website unter
www.3M.com/foodsafety oder wenden Sie sich an den lokalen 3M-Verkaufsvertreter oder Händler.
Erklärung der Symbole
www.3M.com/foodsafety/symbols
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...

3M Health Care
2510 Conway Ave
St. Paul, MN 55144 USA
www.3M.com/foodsafety
© 2018, 3M. All rights reserved.
3M is a trademark of 3M. Used under license in Canada.
34-8722-8096-0
3
3M Food Safety
3M United States
3M Center
Bldg. 275-5W-05
St. Paul, MN 55144-1000
USA
1-800-328-6553
3M Canada
Post Oce Box 5757
London, Ontario N6A 4T1
Canada
1-800-563-2921
3M Latin America
3M Center
Bldg. 275-5W-05
St. Paul, MN 55144-1000
USA
1-954-340-8263
3M Europe and MEA
3M Deutschland GmbH
Carl-Schurz-Strasse 1
D41453 Neuss/Germany
+49-2131-14-3000
3M United Kingdom PLC
Morley Street,
Loughborough
Leicestershire
LE11 1EP
United Kingdom
+(44) 1509 611 611
3M Österreich GmbH
Euro Plaza
Gebaude J, A-1120 Wien
Kranichberggasse 4
Austria
+(43) 1 86 686-0
3M Asia Pacic
No 1, Yishun Avenue 7
Singapore, 768923
65-64508869
3M Japan
3M Health Care Limited
6-7-29, Kita-Shinagawa
Shinagawa-ku, Tokyo
141-8684 Japan
81-570-011-321
3M Australia
Bldg A, 1 Rivett Road
North Ryde, NSW 2113
Australia
61 1300 363 878
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
 26
26
-
 27
27
-
 28
28
-
 29
29
-
 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
-
 39
39
-
 40
40
-
 41
41
-
 42
42
-
 43
43
-
 44
44
-
 45
45
-
 46
46
-
 47
47
-
 48
48
-
 49
49
-
 50
50
-
 51
51
-
 52
52
-
 53
53
-
 54
54
-
 55
55
-
 56
56
-
 57
57
-
 58
58
-
 59
59
-
 60
60
-
 61
61
-
 62
62
-
 63
63
-
 64
64
-
 65
65
-
 66
66
-
 67
67
-
 68
68
-
 69
69
-
 70
70
-
 71
71
-
 72
72
-
 73
73
-
 74
74
-
 75
75
-
 76
76
-
 77
77
-
 78
78
-
 79
79
-
 80
80
-
 81
81
-
 82
82
-
 83
83
-
 84
84
-
 85
85
-
 86
86
-
 87
87
-
 88
88
-
 89
89
-
 90
90
-
 91
91
-
 92
92
-
 93
93
-
 94
94
-
 95
95
-
 96
96
-
 97
97
-
 98
98
-
 99
99
-
 100
100
-
 101
101
-
 102
102
-
 103
103
-
 104
104
-
 105
105
-
 106
106
-
 107
107
-
 108
108
-
 109
109
-
 110
110
-
 111
111
-
 112
112
-
 113
113
-
 114
114
-
 115
115
-
 116
116
-
 117
117
-
 118
118
-
 119
119
-
 120
120
-
 121
121
-
 122
122
-
 123
123
-
 124
124
-
 125
125
-
 126
126
-
 127
127
-
 128
128
-
 129
129
-
 130
130
-
 131
131
-
 132
132
-
 133
133
-
 134
134
-
 135
135
-
 136
136
-
 137
137
-
 138
138
-
 139
139
-
 140
140
-
 141
141
-
 142
142
-
 143
143
-
 144
144
-
 145
145
-
 146
146
-
 147
147
3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Bedienungsanleitung
- Typ
- Bedienungsanleitung
in anderen Sprachen
- English: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Operating instructions
- français: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Mode d'emploi
- español: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Instrucciones de operación
- italiano: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Istruzioni per l'uso
- русский: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Инструкция по эксплуатации
- Nederlands: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Handleiding
- português: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Instruções de operação
- dansk: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Betjeningsvejledning
- polski: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Instrukcja obsługi
- čeština: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Operativní instrukce
- svenska: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Bruksanvisningar
- 日本語: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case 取扱説明書
- Türkçe: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Kullanma talimatları
- suomi: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Käyttö ohjeet
- română: 3M Microbial Luminescence System Ultra High Temperature (UHT) Dairy Screen Kit DPQCOG3000, 3000 per case Instrucțiuni de utilizare
Verwandte Papiere
-
3M Molecular Detection Assay 2 - Listeria MDA2LIS96, 96 tests, 1 ea Bedienungsanleitung
-
3M Molecular Detection Assay 2 - Campylobacter MDA2CAM96, 96 tests, 1 ea Bedienungsanleitung
-
3M Molecular Detection Assay 2 - Salmonella MDA2SAL96, 96 tests, 1 ea Bedienungsanleitung
-
3M Allergen Protein Rapid Kit Bedienungsanleitung
-
3M Allergen Protein Rapid Kit Bedienungsanleitung
-
3M Allergen Protein ELISA Kit Bedienungsanleitung
Sonstige Unterlagen
-
JB systems MLS-50 Bedienungsanleitung
-
 Hologic Detection Reagent Kit Bedienungsanleitung
Hologic Detection Reagent Kit Bedienungsanleitung
-
 Hologic AccuProbe culture identification reagent kit Bedienungsanleitung
Hologic AccuProbe culture identification reagent kit Bedienungsanleitung
-
 Red Sea Marine Care Bedienungsanleitung
Red Sea Marine Care Bedienungsanleitung
-
 Hologic LDRCheck D Bedienungsanleitung
Hologic LDRCheck D Bedienungsanleitung
-
Me DVR-3004 Bedienungsanleitung
-
Leica PA0027 Benutzerhandbuch
-
VWR INCU-Line IL 56 Short Instruction Manual
-
Beta 1462/KU Bedienungsanleitung
-
Roche cobas x 480 Benutzerhandbuch






















































































































































