Corning Ascent® Festbettreaktor-Prozessentwicklungssyste Bedienungsanleitung
- Typ
- Bedienungsanleitung

Corning® Ascent® Festbettreaktor-
Prozessentwicklungssystem
Gebrauchsanleitung
Bestellnummer: 6970

CORNING ASCENT FBR PD-SYSTEM
Inhaltsverzeichnis
1.0 Sicherheit .................................................................. 1
1.1. Persönliche Schutzausrüstung (PSA) ...................................1
1.2 Gerätesicherheit .........................................................................1
2.0 Einführung ................................................................ 2
3.0 Standortanforderungen ........................................... 3
4.0 Einrichtung und Installation .................................... 4
4.1 Strom-, Luft- und Gasanschlüsse ........................................... 4
5.0 Übersicht über das Gerät ......................................... 5
5.1 Vorsterilisierte Verbrauchsmaterialien.................................5
5.1.1 Medienzugabe- und Medienabfallflaschen .............. 5
5.1.2 Medienaufbereitungsgefäß (MCV) ............................. 5
5.1.3 Sensorträger ...................................................................... 7
5.1.4 Inokulum-, Basen- und Feedflaschen ......................... 8
5.1.5 FBR mit sterilen Anschlüssen ........................................ 8
5.1.6 Erntekit ............................................................................... 9
5.1.7 Sterile Anschlüsse .......................................................... 11
5.2 Schnittstellenfeld .....................................................................11
5.2.1 Rührwerksmotor ............................................................12
5.2.2 Abluftfilterheizung ........................................................ 12
5.2.3 Drucksensor ..................................................................... 13
5.2.4 MCV-Durchperlung ........................................................13
5.2.5 MCV-Temperatursensor ................................................ 13
5.2.6 MCV- und FBR-Sensoren für gelösten Sauerstoff (DO)
14
5.2.7 MCV-pH-Sensor ..............................................................14
5.3 Pumpen.......................................................................................14
5.4 Quetschventile ..........................................................................15
5.4.1 Positionen der Quetschventile ...................................16
5.5 MCV- und FBR-Heizungen......................................................17
5.5.1 MCV-Heizung und Temperatursensor ......................17
5.5.2 FBR Inline-Heizung und Temperatursensor ............18
5.6 Barcodescanner ........................................................................18
6.0 Prozessübersicht ..................................................... 19
6.1 Einrichten des Systems ........................................................... 20
6.1.1 Initialisierung .................................................................. 21
6.1.2 Phase mit Medienbefüllung und Priming ............... 21
6.1.3 Medienaufbereitungsphase ........................................21
6.1.3.1 Sensorkalibrierung ................................................21
6.2 Zellkultur ....................................................................................22
6.2.1 Medienversorgung .........................................................22
6.2.2 Inokulation ....................................................................... 22
6.2.3 Medienaustausch ...........................................................22
6.2.4 Transfektion ..................................................................... 23
6.3 Hilfsphasen ................................................................................23
6.3.1 Substrat-Probenahme ...................................................23
6.3.2 Medienzugabe ................................................................ 23
6.3.3 Zugabe von Bolus (oder Feed) .....................................23
6.3.4 Medienentnahme ..........................................................24
6.3.5 Perfusion oder Medienaustausch ..............................24
6.3.6 Medienverdünnung .......................................................24
6.4 Ernte ............................................................................................24
6.4.1 Erntevorbereitung ..........................................................25
6.4.2 Erntewaschung ...............................................................25
6.4.3 Zellfreisetzung ................................................................ 25
6.4.4 Entnahme der Zellen ..................................................... 26
6.4.5 Letzte Spülung ................................................................26
7.0 Bedieneroberfläche (HMI) ...................................... 27
7.1 Überblick über den Hauptbildschirm .................................27
7.2 Anzeigesymbole, Farben und Modi .....................................28
7.3 Zugriffsebenen und Anwendermodi ..................................31
7.4 Bildschirm „System“ ................................................................ 32
7.5 Phasenstatus, Abbruch und globales Zurücksetzen .......33
7.6 Medien-, Ernte- und Hilfsphasen ......................................... 34

Gebrauchsanleitung
7.6.1 Navigieren durch die Sequenz- und
Hilfsphasen-Faceplates ................................................37
7.7 Kalibrierung ...............................................................................37
7.8 Faceplates für die Gerätesteuerung .................................... 38
7.8.1 Faceplates zur Regelung der Geräteparameter ...... 39
7.8.2 Gerätesummierer-Faceplate ........................................40
7.8.3 Faceplate des PID-Regelkreises
(Proportional, Integral und Differential) ..................40
7.9 Einrichtung der Regelkreise ...................................................42
7.9.1 MCV-DO-Regelung ......................................................... 42
7.9.1.1 Beispiele für die Konfiguration des
MCV-DO-Regelkreises ...........................................42
7.9.2 MCV-pH-Regelung ......................................................... 44
7.9.3 Bioreaktor-DO-Regelung ..............................................46
7.10 Zugriff auf die Trend-Eigenschaften .................................46
7.10.1 Eine neue Zeitspanne erstellen ................................47
7.10.2 Funktionen der Tag-Liste ...........................................48
7.10.3 Kurve anzeigen ............................................................. 49
7.10.4 Vorlagen .........................................................................51
7.10.4.1 So erstellen Sie eine Vorlage ............................51
7.10.4.2 Eine vorhandene Vorlage anwenden .............51
7.10.4.3 Änderungen an einer bestehenden
Vorlage speichern ................................................52
7.10.4.4 Tags zur Vorlage hinzufügen ............................52
7.10.4.5 Vorlagen-Tags entfernen ...................................54
7.10.4.6 Daten vergrößern und navigieren ..................54
7.10.4.7 Trend-Eigenschaften ...........................................55
7.11 Daten verarbeiten .................................................................55
7.11.1 Metadateneingabe ......................................................56
7.11.2 Datendateieingabe...................................................... 56
7.11.3 Rezirkulationsvolumen ...............................................57
7.11.4 USB-Speichern ..............................................................57
7.12 Diagnose ..................................................................................58
7.13 VPN Aktiviert ..........................................................................59
7.14 Alarme ......................................................................................59
7.14.1 Verriegelungen ohne Alarm ......................................61
7.15 Stromausfall und Wiederherstellung ...............................62
8.0 Protokolle ................................................................ 63
8.1 Pumpenkalibrierung ..............................................................65
8.2 Medienphasen ..........................................................................67
8.2.1 Initialisierungsphase .....................................................67
8.2.1.1 Lynx®-Anschlüsse ..................................................72
8.2.1.2 AseptiQuik® G-Anschlüsse ..................................74
8.2.2 Phase mit Medienbefüllung und Priming ............... 75
8.2.3 Medienaufbereitungsphase ........................................78
8.2.3.1. Sensorkalibrierung ...............................................79
8.2.4 Medienversorgungsphase ...........................................80
8.2.5 Inokulationsphase ......................................................... 81
8.2.5.1 MCV-Impfung (bevorzugte Option) ..................83
8.2.5.2 FBR-Inokulation ......................................................84
8.2.5.3 Hinzufügen der Base ............................................86
8.2.6 Medienaustauschphase ...............................................86
8.2.7 Transfektionsphase (prozessabhängig) .................... 88
8.2.8 Transfektion (mit der Feedpumpe) ............................89
8.3 Hilfsphasen ................................................................................90
8.3.1 Substrat-Probenahme ...................................................91
8.3.2 Medienentnahmephase ...............................................95
8.3.3 Medienzugabephase .....................................................95
8.3.4 Hinzugabe von Bolus ....................................................96
8.3.5 Perfusion ..........................................................................97
8.3.6 Medienverdünnungsphase (prozessabhängig) ......98
8.4 Erntephasen ..............................................................................98
8.4.1 Erntevorbereitung ..........................................................99
8.4.2 Erntewaschung .............................................................104
8.4.3 Zellfreisetzung ..............................................................105
8.4.4 Zellentnahme ................................................................106

CORNING ASCENT FBR PD-SYSTEM
8.4.5 Letzte Spülung ..............................................................107
8.5 In-Situ Manuelles-Lyse-Protokoll ....................................... 108
8.5.1 Zellkulturmedien entnehmen ..................................108
8.5.2 Lyse ...................................................................................109
8.5.3 PBS-Wäsche ...................................................................109
8.5.4 Waschlösung mit hohem Salzgehalt
(optional) .......................................................................110
8.6 Abschaltverfahren ................................................................110
9.0 Vorbeugende Wartung ......................................... 111
9.1 Empfohlene Liste................................................................... 111
9.2 Routinemäßige Reinigung des Bildschirms ................... 111
9.3 Verfahren zum Austauschen des Gasfilters ................... 112
9.4 Auswechseln der Gehäusefilter ........................................ 113
10.0 Kundendienst ...................................................... 115
11.0 Entsorgung von Geräten .................................... 115
Anhang 1: PID-Regelberechnungen und
Einstellanleitung ....................................... 116
Anhang 2: Phasenfreigabe ......................................... 117
Anhang 3: Referenztabellen für die
Betriebsabläufe......................................... 118
1. Medienphasen ......................................................................... 118
2. Hilfsphasen ............................................................................... 127
3. Erntephasen .............................................................................. 131
Anhang 4: Kurzanleitung ........................................... 133
Einrichtung .................................................................................... 133
Versuchslauf .................................................................................. 134
Ernte einrichten ............................................................................135

1
Gebrauchsanleitung
1.0 Sicherheit
In diesem Abschnitt wird beschrieben, wie Sie das Corning® Ascent® Festbettreaktor-Prozessentwicklungssystem (FBR PD) sicher einrichten und verwenden.
1.1. Persönliche Schutzausrüstung (PSA)
Bei Besiedlung und Ernte werden ungiftige Medien verwendet. Zur grundlegenden PSA gehören:
• Augenschutz
• Laborkittel
• Untersuchungshandschuhe bei der Handhabung von Medien
• Gesichtsschutz, insbesondere bei Ernteprotokollen
1.2 Gerätesicherheit
Tabelle 1-1. Warnhinweise.
Warnhinweis Beschreibung
Symbol für hohe Spannungen. Um die Verletzungsgefahr zu verringern, schalten Sie das
Gerät vor der Wartung aus und ziehen Sie den Netzstecker.
Symbol für biologische Gefahren. Tragen Sie bei der Handhabung von Medien
ordnungsgemäße PSA.
Symbol für heiße Oberflächen. Vermeiden Sie es, die folgenden beheizten Oberflächen zu
berühren:
• Medienaufbereitungsgefäß (Media Conditioning Vessel, MCV) und Bioreaktornester
• Abluftfilterheizung
Schalten Sie vor der Wartung die Stromversorgung ab und lassen Sie die Oberfläche
abkühlen.
Symbol für schwere Gegenstände. Um Verletzungen zu vermeiden, sind zum Anheben des
Ascent-Geräts gemäß OSHA-Norm mindestens zwei Personen erforderlich.
Lesen und verstehen Sie die Bedienungsanleitung, bevor Sie das Gerät benutzen.
Nichtbeachtung kann zu Verletzungen führen.

2CORNING ASCENT FBR PD-SYSTEM
Abbildung 2-2. Flaschenfach mit Barcodescanner (siehe Tabelle 2-1).
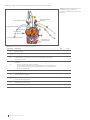
Abbildung 2-1. Corning Ascent FBR PD-System
(siehe Tabelle 2-1).
2.0 Einführung
Das Corning® Ascent® FBR PD-System besteht aus einem Systemcontroller und vorsterilisierten Einwegkomponenten, einschließlich eines Bioreaktors, eines
Medienaufbereitungsgefäßes (MCV) und anderer Verbrauchsmaterialien wie Schläuche, Anschlüsse, Sonden, Inline-Sensoren und Flaschen (Abbildung 2-1
und Abbildung 2-2).
Während der Zellkultur zirkuliert eine Umwälzpumpe die Medien aus dem MCV durch den FBR. Eine separate Pumpe hilft dabei, verbrauchte Medien
zu entfernen und das MCV während der Medienversorgung mit frischen Medien zu versorgen. Der pH-Wert der Zellkultur und der Nährstoffgehalt
werden über Feed- und Basenpumpen überwacht und aufrechterhalten, während temperaturgeregelte Heiznester das MCV und den Bioreaktor auf einer
konstanten Temperatur halten. Bei der Ernte werden die Zellen je nach Ermessen des Anwenders in situ aus dem Bioreaktor entnommen oder lysiert. Die
Bedieneroberfläche (Human-Machine Interface, HMI) bietet dem Anwender die Flexibilität, das System manuell oder automatisiert zu betreiben.

3
Gebrauchsanleitung
Tabelle 2-1. Übersichtstabelle der Hauptkomponenten.
Beschriftung Komponente Referenz
1Bedieneroberfläche (HMI) Abschnitt 7.0
2Medienaufbereitungsgefäß (MCV) Abschnitt 5.1.2
3Festbettreaktor (Fixed Bed Reactor, FBR) mit sterilem
Anschlussfach
Abschnitt 5.1.5
4Beheiztes Nest des Bioreaktors Abschnitt 5.5
5 Umwälzpumpe Abschnitt 5.3
6 Medienpumpe Abschnitt 5.3
7 Quetschventil(e) Abschnitt 5.4
8 Schnittstellenfeld Abschnitt 5.2
9Gestell für Inokulum-, Basen- und Feedflaschen Abschnitt 5.1.4
10 Flaschen für Medienzugabe und Medienabfall Abschnitt 5.1.1
11 Barcodescanner Abschnitt 5.6
3.0 Standortanforderungen
In Tabelle 3-1 sind die Standortanforderungen für die Einrichtung des Corning® Ascent® FBR PD-Geräts aufgeführt.
Tabelle 3-1. Standortanforderungen.
Typ Beschreibung
Betriebsbedingungen Das Gerät ist auf die Verwendung unter Standardbetriebsbedingungen gemäß UL 61010-1 ausgelegt:
• Der Innentemperaturbereich liegt bei 5 °C bis 40 °C.
Für eine optimale Nutzung sollte der Innentemperaturbereich zwischen 20 °C und 30 °C liegen.
• Maximale relative Luftfeuchtigkeit von 80 % bei Temperaturen bis zu 30 °C
• Maximale Höhe bis zu 2.000 m
• Verschmutzungsgrad 2
• Bis zur IEC-Überspannungskategorie II für transiente Überspannungen
Erforderlicher Platz Ein für die Abmessungen des Geräts geeigneter Labortisch (L x B x H) 53 x 30 x 27 Zoll (134,62 x 76,2 x 68,58 cm).
Der Labortisch muss so bemessen sein, dass er bei Bedarf zusätzliche Verbrauchsmaterialien aufnehmen kann.
Systemgewicht Das Grundgewicht (ohne Verbrauchsmaterialien) beträgt ca. 186 lbs. (84,36 kg).
Leistungsaufnahme Bestell- Nr. 6970, 120 V AC/60 Hz/1 Phase, 527 W
Bestell- Nr. 6991, 230 V AC/50 Hz/1 Phase, 595 W
Eine eigene, mit 20 A abgesicherte Steckdose ist erforderlich.
Eine unterbrechungsfreie Stromversorgung (USV) und ein Überspannungsschutz werden empfohlen.
Gasanschluss und Typ Alle kalibrierten Massendurchflussregler (Mass Flow Controller, MFC) sind auf 30 bis 35 psig (2,0 bis 2,4 barg)
der jeweiligen Gase ausgelegt.
Der erforderliche Anschlusstyp ist 1/4" (6 mm) AD halbstarrer, flexibler Schlauch für Einlass-Druckanschlüsse.
Datenübertragung EtherNet/IP

4CORNING ASCENT FBR PD-SYSTEM
Abbildung 4-2. Ein-/Ausschalttaste des Regelsystems,
USB-Anschluss und EtherNet/IP-Anschluss.
Abbildung 4-3. Druckanschluss bei der Ernte.
Abbildung 4-1. Strom-, Luft- und Gasanschlüsse auf der
Rückseite des Geräts.
4.0 Einrichtung und Installation
In diesem Abschnitt wird beschrieben, wie Sie das Corning® Ascent® FBR-Gerät anschließen und einschalten.
4.1 Strom-, Luft- und Gasanschlüsse
Der Corning Ascent FBR ist ein Tischgerät mit zugänglichen Anschlüssen für Strom, Luft, O2, CO2 und N2 (Abbildung 4-1). Drücken Sie die Ein-/Aus-LED-Taste
an der vorderen linken Basis des Geräts (Abbildung 4-2), um die HMI zu starten. Die LED-Taste leuchtet grün, wenn das Gerät eingeschaltet ist. Lassen Sie
das System 30 Minuten lang aufwärmen, bevor Sie einen Lauf starten. Ein Druckanschluss (Abbildung 4-3) an der linken Ecke der Gerätebasis ist nur bei der
Ernte angeschlossen.
AC-Versorgung
Luft Q2 CO2 N2
USB-Anschluss
(mit Abdeckung)
Strom EIN/AUS
EtherNet/IP-Anschluss
Ernte-
Druckanschluss

5
Gebrauchsanleitung
5.0 Übersicht über das Gerät
In diesem Abschnitt wird das Corning® Ascent® FBR-Gerät beschrieben, einschließlich der vorsterilisierten Verbrauchsmaterialien und des
Systemcontrollers.
5.1 Vorsterilisierte Verbrauchsmaterialien
Tabelle 5-1 enthält eine Liste der vorsterilisierten Verbrauchsmaterialien für den Einmalgebrauch, die gemäß den örtlichen und staatlichen Gesetzen
ordnungsgemäß als biologischer Sonderabfall entsorgt werden müssen. Die Verbrauchsmaterialien dürfen nicht wiederverwendet werden.
Tabelle 5-1. Übersicht über die Verbrauchsmaterialien.
Verbrauchsmaterial Abbildung Referenz
Medienaufbereitungsgefäß (MCV) mit Sensorträger Abbildung 5-1 Abschnitte 5.1.2 und 5.1.3
Medienzugabeflasche Abbildung 2-2 Abschnitt 5.1.1
Medienabfallflasche Abbildung 2-2 Abschnitt 5.1.1
Inokulum-Flasche Abbildung 5-5 Abschnitt 5.1.4
Basenflasche Abbildung 5-5 Abschnitt 5.1.4
Feedflasche Abbildung 5-5 Abschnitt 5.1.4
Festbettreaktor (FBR) und sterile Anschlüsse Abbildungen 5-6 und 5-7 Abschnitt 5.1.5
Flasche für die Erntewaschung Abbildung 5-10 Abschnitt 5.1.6
Flasche mit Erntelösung Abbildung 5-10 Abschnitt 5.1.6
Flasche zum Sammeln von Erntegut Abbildung 5-10 Abschnitt 5.1.6
Spülflasche Abbildung 5-10 Abschnitt 5.1.6
Abfallflasche Abbildung 5-10 Abschnitt 5.1.6
Abbildung 5-1. Medienrezirkulations- und
Rücklaufleitungen über den Lynx®-Anschluss
und sterile Anschlüsse zu den Feed- und
Basenflaschen.
5.1.1 Medienzugabe- und Medienabfallflaschen
Frische Zellkulturmedien, die während des Auffüllens und Austauschs von Medien verwendet werden, werden in die Medienzugabeflasche an der Seite des
Ascent-Geräts gefüllt (Abbildung 2-2). Die Medien werden über Schläuche und die Medienpumpe in das Medienaufbereitungsgefäß (MCV) geleitet. Über
AseptiQuik®-Anschlüsse kann bei Bedarf mehr als eine Medienzugabeflasche angeschlossen werden.
Während des Medienaustauschs werden die verbrauchten Medien in die Medienabfallflasche entsorgt, die sich ebenfalls im selben Gehäuse an der Seite
des Geräts befindet. Sie ist über einen parallelen Schlauch angeschlossen, der vom MCV ausgeht. Der Medienabfall wird von der Medienpumpe durch die
Schläuche abgeführt. Je nach Bedarf kann mehr als eine Medienabfallflasche angeschlossen werden.
Es gibt zwei Quetschventile, das rote und das orangefarbene Quetschventil, die zusammenarbeiten, um entweder frische Medien zum MCV zu leiten oder
verbrauchte Medien aus dem MCV abzuführen (siehe Abschnitt 5.4 für weitere Einzelheiten).
5.1.2 Medienaufbereitungsgefäß (MCV)
Die Medienpumpe führt dem MCV frische Medien zu und die Umwälzpumpe lässt Medien durch den Bioreaktor strömen. Der MCV befindet sich in
einem beheizten Nest, während sein Inhalt mit einer programmierten Geschwindigkeit gerührt wird, um die Homogenität und den gewünschten Gehalt
an gelöstem Sauerstoff (Dissolved Oxygen, DO) in den Medien während der Zellkultur aufrechtzuerhalten. Abbildung 5-1 zeigt eine Übersicht über die
Schlauchverbindungen zwischen dem MCV und dem Bioreaktor über die Lynx®-Anschlüsse.
Abluft-/Belüftungsfilter
(ohne Heizmantel)
Gas-/Durchperlungsleitung
Stecker des MCV-Temperatursensors
Stecker des
Druckmessumformers
FBR-Inokulationsanschluss
Klemme der FBR-
Inokulationsleitung
Sensorträger
Hier montierter
Rührwerksmotor
AseptiQuik® S-Anschlüsse für
Feed- und Basenflaschen
Klemme für
Rezirkulationsleitung
Druckentlastungskreis
Rezirkulationsleitung
Medienrücklaufleitung
Transfektions- und Inokulationsstellen
Lynx®-Anschlüsse zum FBR
Medienrücklaufleitung

6CORNING ASCENT FBR PD-SYSTEM
Tabelle 5-2. Schläuche und Anschlüsse an der MCV-Kopfplatte.
Beschriftung Beschreibung EIN AUS
T1 Nicht verwendet.
T2 Für die Zu- und Abfuhr von Medien zum bzw. aus dem MCV.
T3
Für die Leitung von MCV-Medien durch die Sensorträger- und die sterilen Anschlüsse
in den Bioreaktor. Der Schlauch ist mit einem Sensor ausgestattet, der die MCV-
Temperatur überwacht.
T4
Für die Rückführung von Medien aus dem Bioreaktor. Die Leitung verfügt über zwei
Funktionen:
• Anschluss für die Probennahme von Medien.
• Das Ventil wird manuell geöffnet, wenn der Bioreaktor manuell entleert wird (z. B.,
bei der Substratprobennahme und dem Medienaustausch). Die Standardposition
des Ventils ist geschlossen.
T5 Zur aseptischen Leitung von Transfektionsmittel und Inokulum zum MCV.
T6 Schlauchleitung mit roten und blauen Clips zur Feedflasche. Das Feed wird dem MCV
über die Feedpumpe zugeführt.
T7 Schlauchleitung mit gelben und blauen Clips zur Basenflasche. Die Base wird dem MCV
über die Basenpumpe zugeführt.
p1 Zusätzlicher Luer-Lock-Anschluss.
p2 Luer-Lock-Anschluss für die Probennahme von Medien.
Abbildung 5-2. MCV-Kopfplattenanschlüsse
für Medienversorgung, Transfektion,
Inokulation und Medienprobenahme (siehe
Tabelle 5-2).
Abbildung 5-2 zeigt die Anschlüsse der MCV-Kopfplatte, die Schläuche und die Anschlüsse.
Abluft-/Entlüftungsleitung
Stecker des MCV-
Temperatursensors
Gas-/Durchperlungsleitung
Stecker des Druckmessumformers
Rührwerksantrieb
Ventil (normalerweise
geschlossen)
Transfektions- und
Inokulationsstellen

7
Gebrauchsanleitung
Im Inneren des MCV befinden sich die folgenden Komponenten (Abbildung 5-3):
• Eine Rührwerkswelle mit einem rotierenden 6-blättrigen Scheibenrührer, die eine homogene Durchmischung von Medien ermöglicht.
• Ein Dip-Röhrchen, das mit der Gas-/Durchperlungsleitung verbunden ist.
• Ein Dip-Röhrchen für die Medienzugabe, die Medienentnahme und den Medienrücklauf
• Ein Dip-Röhrchen für die Medienrezirkulation vom MCV zum Bioreaktor
• Ein Anschlusssegment für den Medienrücklauf aus dem Bioreaktor (in Abbildung 5-3 nicht sichtbar)
5.1.3 Sensorträger
Der Sensorträger passt zwischen das MCV und die Umwälzpumpe (Abbildung 5-4), um die Sensoren und die Schläuche der Umwälzpumpe richtig zu
positionieren. Die beiden Stücke der Medienschläuche, die das MCV mit dem Bioreaktor verbinden (über sterile Anschlüsse), werden zusammen mit zwei
Inline-DO-Sensoren und einem Inline-MCV-pH-Sensor über den Träger geklemmt.
Der Sensorträger dient den folgenden Zwecken:
• Ermöglicht ein einfaches Beladen und Installieren des Pumpenschlauchs in der Umwälzpumpe.
• Ermöglicht eine einfache farbliche Kennzeichnung für den Anschluss von Sensoren, die den Gehalt an gelöstem Sauerstoff im MCV und FBR sowie
den MCV-pH-Wert überwachen.
Abbildung 5-3. Im Inneren des MCV
befindet sich ein angetriebenes
Rührwerk; ein Dip-Röhrchen für die Gas-/
Durchperlungsleitung; Dip-Röhrchen für
Medienzugabe, -entnahme und -rücklauf;
und das Dip-Röhrchen für die MCV-
Medienrezirkulation.
Abbildung 5-4. Der Sensorträger enthält
Medienschläuche mit Inline-pH- und
DO-Sensoren, die zur Überwachung der
Medienbedingungen an die Oberfläche
geklemmt werden.
Dip-Röhrchen (Position:
hinten links (Gas-/
Durchperlungsleitung)
Scheibenrührer
auf dem Sockel der
Rührwerkswelle
Dip-Röhrchen (Position: hinten rechts)
(Medienzugabe, -entnahme und -rücklauf)
Dip-Röhrchen (an der Vorderseite)
(zum Bioreaktor)
Anschlüsse am
Schnittstellenfeld
MCV DO
MCV pH
FBR DO
Zum MCV
Sensorträger Pumpenschläuche
Zum Bioreaktor
Umwälzpumpe

8CORNING ASCENT FBR PD-SYSTEM
Tabelle 5-3. Beschreibungen der Basen-, Feed- und Inokulum-Flaschen.
Flasche Beschreibung
Base (oder Alkali) Diese Flasche enthält eine basische Lösung, um den pH-Wert der Zellkulturmedien im MCV einzustellen.
Das Ascent System ist so konzipiert, dass es den pH-Wert des MCV-Zellkulturmediums automatisch
aufrechterhält, indem es die Basenlösung über die Basenpumpe hinzufügt und den Pumpendurchfluss
mit anwenderdefinierten Sollwerten regelt. Die Zugabe einer Basenlösung während des Zellwachstums
neutralisiert eine übermäßige Konzentration von H+-Ionen und verhindert somit, dass das Medium zu
sauer wird. Ein Beispiel für eine Basenlösung ist eine 7,5 %ige Natriumbicarbonatlösung.
Feed (oder Bolus) Diese Flasche enthält konzentrierte Ergänzungsmittel, die, wenn sie den Medien zugefügt werden, die
Nährstoffkonzentration während der Zellkultur erhöhen können. Das Feed wird mit einer programmierten
Rate über die Feedpumpe in das MCV gepumpt.
Optional können Nährstoffe wie Glukose (45%) und L-Glutamin (200 mm) in großen Mengen über die
Feedleitung zugegeben werden, um die Konzentrationen zu erhöhen.
Inokulum (oder
Zellsuspension)
Diese Flasche enthält eine konzentrierte Zellsuspension in einem Medium, das zum Besiedeln des
Bioreaktors verwendet wird. Die Besiedelung kann über das MCV erfolgen.
5.1.5 FBR mit sterilen Anschlüssen
Das Corning® Ascent® FBR-System bietet zwei Optionen, um den Medienfluss vom MCV zum FBR und den Medienrücklauf vom FBR zum MCV zu verbinden.
Option A verwendet Lynx®-Anschlüsse, während Option B AseptiQuik® G-Abschlüsse verwendet (Abbildung 5-6 und Abbildung 5-7). Zu Beginn des
Experiments werden die sterilen Anschlüsse (Option A oder B) mit den entsprechenden sterilen Anschlüssen am MCV verbunden.
Die Lynx®-Anschlüsse bieten dem Anwender den zusätzlichen Vorteil, dass er den FBR bis zu sechs Mal für manuelle Manipulationen aseptisch anschließen
und trennen kann, um Substratproben zu entnehmen. Mit dem tragbaren Tablett können die Anwender den abgetrennten FBR und die Lynx®-Anschlüsse
bequem in einen Biosicherheitsschrank bringen. Der AseptiQuik® G ist ein Einweganschluss und kann nicht abgetrennt oder wieder angesteckt werden.
5.1.4 Inokulum-, Basen- und Feedflaschen
Das Inokulum wird während eines Experiments manuell zugegeben. Der Anwender wählt einen der beiden AseptiQuik® G-Anschlüsse an der MCV-
Kopfplatte aus (siehe Abbildung 5-2). Die Base wird automatisch als Teil des pH-Regelkreises hinzugefügt. Die Basen- und Feed-Leitungen verfügen über
entsprechende Pumpen, die vor der Verwendung eingerichtet werden müssen. Abbildung 5-5 zeigt ein Gestell für Basen-, Feed- und Inokulum-Flaschen.
Beschreibungen finden Sie in Tabelle 5-3.
Abbildung 5-5. Die Basen- und Feedflaschen werden während eines
automatischen Zyklus an ihre jeweiligen Pumpen angeschlossen. Das
Inokulum wird manuell zugeführt.
Basenflasche
Feedflasche
AseptiQuik® S-
Anschlüsse
Feedpumpe Basenpumpe
Inokulum-Flasche
AseptiQuik® G-Anschluss

9
Gebrauchsanleitung
Der Bioreaktor verfügt über eine sanitäre Drehklemme, die einen einfachen Zugang zu dem darunter befindlichen segmentierten Probenahmesieb
ermöglicht (Abbildung 5-8). Die 3 Probenahmesiebe (Abbildung 5-9) sind in sechs Segmente unterteilt, die sich leicht entfernen lassen. Die Segmente
können entfernt werden, um das Zellwachstum im FBR zu überwachen.
Abbildung 5-6. FBR- und Lynx®-Anschlüsse. Abbildung 5-7. FBR- und AseptiQuik® G-Anschlüsse.
Abbildung 5-9. Ein segmentiertes Probenahmesieb. Es
gibt 3 segmentierte Probenahmenetze mit jeweils 6
Segmenten, insgesamt also 18 Probenahmesegmente.
Jeden Tag können ein oder mehrere Segmente zur
Probenahme entnommen werden.
5.1.6 Erntekit
Das Corning® Ascent® FBR-System verfügt über ein Verbrauchsmaterial-Erntekit in einem tragbaren Tablett zur einfachen Positionierung, mit dem
Anwender Zellen aus dem Bioreaktor gewinnen können (Abbildung 5-10).
Vor der Ernte wird der Bioreaktor durch Abklemmen des Rezirkulationseinlasses und der Auslassschläuche gegenüber dem MCV von den Medien isoliert.
Während der Erntephase lässt die Umwälzpumpe in Verbindung mit den automatischen Quetschventilen die Erntelösungen aus dem Erntekit durch den
Bioreaktor fließen. In Tabelle 5-4 finden Sie Beschreibungen der Erntekits.
Abbildung 5-10. Die Abbildung zeigt das Erntekit. Das
Kit wird nur bei der Ernte aufgestellt.
Abbildung 5-8. Der
Wachstumssiebstapel und die
einzelnen Probenahmesiebe
können aus dem Bioreaktorgefäß
entnommen werden.
Sanitäre Drehklemme
Übereinanderliegende
Probenahmesiebe
Wachstumssiebstapel
Führungsstange
Zylinder des Gefäßes
Bioreaktor

10 CORNING ASCENT FBR PD-SYSTEM
Abbildung 5-11. Anordnung des
Durchflusses der Erntelösung mit
Lynx®-Anschlüssen. Die Ernteschläuche
werden über AseptiQuik® G-Anschlüsse
angeschlossen. Schlauchklemmen
verschließen die Lynx®-
Verbindungsleitungen, damit Wasch- und
Erntelösungen in den Bioreaktor gelangen
können.
Tabelle 5-4. Erntekit.
Beschriftung Flasche/Gefäß Beschreibung
HC Erntesammlung
(Harvest Collection)
Diese Flasche wird verwendet, um die aus dem Bioreaktor geernteten Zellen aufzufangen. Während des Ernteschrittes
spült die Erntelösung die Zellen aus dem Bioreaktor und die Zellsuspension wird in der Sammelflasche aufgefangen.
HS Erntelösung
(Harvest Solution)
Diese Flasche enthält eine Erntelösung wie Accutase® oder ein ähnliches proteolytisches zelldissoziierendes Enzym.
Zur vollständigen Rückgewinnung der geernteten Zellen aus dem Bioreaktor wird empfohlen, den Bioreaktor nach der
Ernte mit DPBS-Lösung zu waschen.
HW Erntewaschlösung
(Harvest Wash)
Diese Flasche enthält DPBS, um das Zellkulturmedium aus dem Bioreaktor zu entfernen, bevor die Erntelösung eingefüllt
wird. Diese Flasche wird auch nach dem Einfüllen der Erntelösung beim Waschen nach der Ernte verwendet.
Einige Bestandteile der Zellkulturmedien können die aktiven Enzyme der Erntelösung inaktivieren. Daher wird empfohlen,
vor der Einführung der Erntelösung eine DPBS-Wäsche im Bioreaktor durchzuführen.
FSpüllösung (Flush) Die Flasche enthält eine vordefinierte Menge an Zelldissoziationsreagenz (Accutase), mit dem die Zellen aus dem
Bioreaktor ‚gespült‘ werden.
Es befinden sich immer etwa 80-100 mL der Erntelösung in der Erntespülflasche.
WAbfall (Waste) In dieser Flasche wird die Waschlösung aufgefangen, die durch den Bioreaktor geflossen ist - bevor das proteolytische
Mittel zugegeben wird.
Abbildung 5-11 zeigt die Anordnung des Flusses der Erntelösung mit Lynx®-Anschlüssen. Während der Ernte bleiben die Lynx®-Anschlüsse mit dem
MCV verbunden, aber die Schlauchklemmen werden bei der Einrichtung der Ernteverbrauchsmaterialien manuell geschlossen, um den Fluss durch
die AseptiQuik®-Anschlüsse umzuleiten. Abbildung 5-12 zeigt die Anordnung für die Ernte bei Geräten mit AseptiQuik® G-Anschlüssen am MCV-
Rezirkulationskreis.
Abbildung 5-12. Anordnung des
Durchflusses der Erntelösung mit
AseptiQuik® G-Anschlüssen für den
Einmalgebrauch.
Ernteleitungen
(AseptiQuik® G-Anschlüsse)
Legende
Klemme (geöffnet)
Fluss der Erntelösung
Auslass des Bioreaktors
Lynx®-Anschluss
Einlass des Bioreaktors
Klemme
(geschlossen)
Rezirkulationsleitung
Rücklaufleitung
Klemme (geschlossen)
Lynx®-Anschluss
Klemme (geöffnet)
Ernteleitungen
(AseptiQuik® G-Anschlüsse)
Legende
Klemme (geöffnet)
Fluss der Erntelösung
Auslass des Bioreaktors
AseptiQuik® G
Einlass des Bioreaktors
Rücklaufleitung
Rezirkulationsleitung
Klemme
(geschlossen)
Klemme (geschlossen)
AseptiQuik® G
Klemme (geöffnet)

11
Gebrauchsanleitung
5.1.7 Sterile Anschlüsse
In Tabelle 5-5 und Tabelle 5-6 sind die sterilen Anschlüsse aufgeführt, die bei der Zellkultur und Ernte verwendet werden.
Tabelle 5-5. Sterile Anschlüsse bei der Medienbefüllung, dem Priming und der Konditionierung.
Lynx® CDR-
Anschluss
AseptiQuik® G
AQG17004
AseptiQuik® S
AQS17002 Anschluss Zweck
(Option A)
(Option B)
MCV zur Rezirkulationsleitung des Bioreaktors Medienperfusion
(Option A)
(Option B)
Bioreaktor-Medienrücklaufleitung Medienperfusion
Medienzugabeflasche 1 zum MCV Medienbefüllung/-zugabe
Medienzugabeflasche 2 zum MCV Medienbefüllung/-zugabe
MCV zur Medienabfallflasche 1 Auffangen von Abfallmedien
MCV zur Medienabfallflasche 2 Auffangen von Abfallmedien
Basenflasche zum MCV Zugabe von Base
Feedflasche zum MCV Zugabe von Feed
Alternativer Anschluss an die Inokulum-Flasche Alternativer Ort für die
Besiedlung des Bioreaktors
Schlauchleitung am MCV Zugabe von Inokulum
Schlauchleitung am MCV Zugabe der Transfektion zum
MCV
Tabelle 5-6. Sterile Verbindungen bei aufgestelltem Erntekit.
AseptiQuik® G
AQG17004
AseptiQuik® DC
AQCDC22004 Anschluss Zweck
Bioreaktor zur Flasche zum Sammeln von
Erntegut
Erntesammlung
Ernteleitung zum Einlass des Bioreaktors Ernteprozess
Ernteleitung zum Auslass des Bioreaktors Ernteprozess
5.2 Schnittstellenfeld
Abbildung 5-13 zeigt das Schnittstellenfeld für verschiedene Sensor- und Komponentenanschlüsse (Details sind in Tabelle 5-7 zu finden).
Abbildung 5-13. Anschlüsse am
Schnittstellenfeld.
Anschlüsse am Schnittstellenfeld

12 CORNING ASCENT FBR PD-SYSTEM
5.2.1 Rührwerksmotor
Der motorgetriebene Scheibenrührer durchmischt die Medien im MCV gleichmäßig. Der magnetisch gekoppelte Rührwerksmotor wird manuell an
der Kopfplatte des MCV montiert (Abbildung 5-14), um die Rührwerkswelle anzutreiben (Abbildung 5-3). Die Rührwerksdrehzahl kann manuell oder
automatisch geregelt werden, um eine angemessene Sauerstoffversorgung des Mediums im MCV zu gewährleisten.
Der empfohlene Betriebsbereich für das Rührwerk liegt zwischen 0 und 400 U/min, wobei die Drehzahl über die HMI auf bis zu 500 U/min eingestellt
werden kann.
HINWEIS: Es wird nicht empfohlen, das Rührwerksmotorkabel an einem Ende abzuziehen, da es sonst zu Fehlfunktionen des Motors kommen kann. Der
Motor sollte in der Motorhalterung aufbewahrt werden, wenn er nicht an einem MCV verwendet wird (siehe Abbildung 5-14).
Abbildung 5-14. Der Anschluss
des Rührwerksmotors wird in das
Schnittstellenfeld eingesteckt. Um
das Rührwerk zu starten oder zu
stoppen, wird der Motor manuell an
der Kopfplatte des MCV angebracht
oder abgenommen.
Beschriftung Schnittstellenfeld Beschreibung Referenz
1 Rührwerksmotor Rührwerksmotorkabel Abschnitt 5.2.1
2 Filterheizung Anschluss Abluftfilterheizung Abschnitt 5.2.2
3 MCV-Druck Inline-Sensor zur Überwachung des Drucks an der MCV-Gasentlüftung Abschnitt 5.2.3
4 MCV-Durchperlung Leitung für das Durchperlungsgas im MCV Abschnitt 5.2.4
5 MCV-Temperatur Ein Inline-Sensor überwacht die Temperatur des Mediums, das das
MCV über den Rezirkulationskreis verlässt
Abschnitt 5.2.5
6FBR DO (DO2) Überwacht den Gehalt an gelöstem Sauerstoff beim Austritt aus dem
Bioreaktor
Abschnitt 5.2.6
7MCV pH Überwacht den pH-Wert beim Austritt aus dem MCV Abschnitt 5.2.7
8MCV DO (DO1) Überwacht den Gehalt an gelöstem Sauerstoff beim Verlassen des
MCV
Abschnitt 5.2.6
Tabelle 5-7. Anschlüsse am Schnittstellenfeld.
5.2.2 Abluftfilterheizung
Eine Abluftleitung (Abbildung 5-15) verhindert den Druckaufbau im MCV. Die Abluftleitung hat einen Filter, der beheizt werden muss, um
Kondensatbildung zu verhindern. Das Beheizen erfolgt über einen wiederverwendbaren Silikonheizmantel, der den Filter trocken hält. Der Heizmantel wird
vor dem Prozess manuell mit Knöpfen um das Filterelement befestigt, so dass der Filter sofort beheizt wird, wenn der Gasfluss beginnt. Die Heiztemperatur
wird auf eine feste Leistungsabgabe geregelt. Ein eingebautes Thermostat verhindert, dass die Temperatur über 65 °C steigt. Ein Drahtgestell hält die
Abluftleitung mit dem gesicherten Heizmantel aufrecht.
HINWEIS: Die Belüftungsfilterheizung wird nur beim Abschalten des Systems ausgeschaltet. Sie bleibt während der Ernte und in situ-Lyse eingeschaltet.
Abbildung 5-15. Der Heizmantel
ist um den Abluftfilter in der
Gasleitung gewickelt.
Motorhalterung
Motoranschluss am
Anschluss eingesteckt
MCV
Motor
Heizmantel am
Anschluss eingesteckt
Heizmantel
(um den Abluftfilter)
Drahtstütze
MCV

13
Gebrauchsanleitung
5.2.3 Drucksensor
Unterhalb des Abluftfilters befindet sich der MCV-Drucksensor (Abbildung 5-16). Er ist darauf ausgelegt, einen niedrigen oder hohen Druck innerhalb des
MCV zu erkennen, der auftreten kann (z. B., wenn der Belüftungsfilter aufgrund von Kondensatansammlungen oder Schaumeintritt in den Abluftfilter
verstopft). Der Sensor leitet das Hochdruckereignis an den Controller weiter. Der Controller reagiert, indem er die Gasventile schließt und alle Kreise in
einen sicheren Zustand versetzt, bis der Druckzustand behoben ist oder das Experiment durch Abschalten beendet wird.
Der normale Betriebsdruckbereich liegt zwischen -0,5 und 2,0 psi. Wenn der Druck -0,5 psi erreicht, schlägt das System Alarm. Wenn der Druck +2 psi
erreicht, werden alle Massendurchflussregler auf 0 sccm gesetzt, und die aktive Stromphase wird in Wartestellung gebracht.
5.2.4 MCV-Durchperlung
Wenn die Gas-/Durchperlungsleitung (Abbildung 5-17) über eine MPC-Verbindung an das Schnittstellenfeld angeschlossen ist, wird der Fluss von O2, Luft,
CO2 und N2 in den Softwareeinstellungen für die Medienaufbereitung reguliert und geregelt. Die Gase fließen durch einen Sterilfilter im MCV.
Die Zusammensetzung der Gasmischung (O2, CO2, Luft, N2) in den Zellkulturmedien wird automatisch vom System geregelt, um die vom Anwender
definierten Werte für Sauerstoffversorgung und pH-Wert aufrechtzuerhalten.
Die Gas-/Durchperlungsleitung verfügt über ein formschlüssiges Absperrventil, das schließt, um sicherzustellen, dass keine Leckage auftritt, wenn die
Sollwerte des Massendurchflussreglers (MFC) gleich Null sind, und das sich öffnet, wenn die MFC-Sollwerte nicht gleich Null sind. Das Ventil ist im
stromlosen Zustand geschlossen (z. B., wenn das System ausgeschaltet ist). Das Ventil schließt sich auch, wenn der Drucksensor (siehe Abschnitt 5.2.3) ein
Hochdruckereignis feststellt.
Abbildung 5-16. Der MCV-Drucksensor
überwacht die Abluftleitung.
Abbildung 5-17. Die Gasleitung
am MCV wird überwacht.
5.2.5 MCV-Temperatursensor
Ein Inline-Temperatursensor im Medienauslass des MCV überwacht die Temperatur des Zellkulturmediums, das aus dem MCV austritt (Abbildung 5-18). Der
Inline-Sensor kann die MCV-Medientemperatur nicht genau messen, wenn die Umwälzpumpe nicht läuft.
Abbildung 5-18. Der MCV-
Temperatursensor überwacht die
erwärmten Medien, die aus dem
MCV in den Bioreaktor fließen.
Abluftfilter
Drucksensor
Abgasdruck an
Anschluss verstopft
MCV
Luftfilter
MCV-Durchperlung
MCV
Temperatursensor eingesteckt
und angeschlossen
Inline-Sensor
Medienauslassschlauch
MCV

14 CORNING ASCENT FBR PD-SYSTEM
5.2.6 MCV- und FBR-Sensoren für gelösten Sauerstoff (DO)
Auf dem Sensorträger befinden sich zwei Sensoren für gelösten Sauerstoff (DO). Der MCV-DO-Sensor ist ein Inline-Sensor, der sich in dem
Schlauchabschnitt zwischen dem MCV und dem Bioreaktor befindet. Der FBR-DO-Sensor ist ebenfalls ein Inline-Sensor, der sich auf der anderen Seite des
Schlauchkreises zwischen dem Bioreaktor und dem MCV befindet (siehe Abbildung 5-19 und Abbildung 5-20). Beide Sensoren sind auf einen reibungslosen
Betrieb der Umwälzpumpe angewiesen, damit die DO-Messungen in den jeweiligen Gefäßen genau sind.
Der gelöste Sauerstoff wird als Luftsättigung in % gemessen (d. h., 100 % Luftsättigung bedeutet, dass die in den Medien gelösten Gase bei normalen
atmosphärischen Bedingungen mit der Luft im Gleichgewicht sind.). Der Anwender legt den MCV-DO-Wert fest, der vom DO-Kaskadenregelkreis über drei
verschiedene Ausgangsvariablen automatisch aufrechterhalten wird: O2 % im Durchperlungsgasgemisch, Durchflussrate des Durchperlungsgases und
Rührwerksdrehzahl. In ähnlicher Weise definiert der Anwender das DO-Ausgangsniveau des FBR, wodurch die Durchflussrate der Umwälzpumpe erhöht
wird, wenn der DO-Wert am Auslass des Bioreaktors unter den Sollwert fällt.
Die Kalibrierungswerte für den DO-Sensor werden vom Hersteller bereitgestellt und können vom Barcode auf dem MCV-Verbrauchsmaterialset abgelesen
oder vom Anwender manuell eingegeben werden.
Abbildung 5-19. MCV-DO-Sensor. Abbildung 5-20. FBR-DO-Sensor.
5.2.7 MCV-pH-Sensor
Der pH-Wert des Zellkulturmediums im MCV wird von einem Inline-Sensor in den Schläuchen auf dem Sensorträger überwacht (Abbildung 5-21). Der
registrierte pH-Bereich liegt zwischen 5,5 und 8,5 und ist anwenderdefiniert. Er wird automatisch über den pH-Controller aufrechterhalten, der zwei
verschiedene Ausgaben regelt: die Durchflussrate der Basenpumpe und die CO2-Durchflussrate (SCCM) im Durchperlungsgasgemisch.
Die Kalibrierungswerte des pH-Sensors werden vom Hersteller bereitgestellt und können durch Scannen des Barcodes im MCV-Verbrauchsmaterialset
automatisch in das System eingelesen oder vom Anwender manuell eingegeben werden.
Abbildung 5-21. Der MCV-pH-
Sensor überwacht den pH-Wert des
Mediums.
5.3 Pumpen
Das Corning® Ascent® FBR-System arbeitet mit vier peristaltischen Pumpen, die für eine bestimmte Anzahl von Vorgängen programmiert sind (Abbildung
5-22). Die beiden großen Pumpenköpfe (Abbildung 5-23) werden für die Medienbefüllung und die Rezirkulation verwendet, während die beiden kleineren
Pumpenköpfe (Abbildung 5-24) für die Automatisierung der Hinzugabe von Feed und Base verwendet werden.
Die großen Pumpen arbeiten in Verbindung mit den Quetschventilen (Abschnitt 5.4: Quetschventile), um den Medienfluss zu steuern. Nur der
Schlauchabschnitt in der Umwälzpumpe ist robust genug, um der Belastung durch kontinuierliches Pumpen bei der Perfusion des Bioreaktors während
des gesamten Prozesses standzuhalten. Sowohl die Umwälz- als auch die Medienpumpe sind so programmiert, dass sie sich je nach Prozessphase im oder
gegen den Uhrzeigersinn drehen.
Die kleineren Pumpen, die Feed- und Basenpumpe, haben farbkodierte Abdeckungen, die dem Anwender das Einlegen und Ausrichten der Schläuche mit
farblich passenden Clips erleichtern. Die Feed- und Basenpumpen sind in eine Richtung programmiert, nämlich im Uhrzeigersinn, um Flüssigkeit in das
MCV zu geben.
Alle vier Pumpen werden vor einem Lauf kalibriert, um die maximale Durchflussrate bei maximaler Ausgabe zu bestimmen (Abschnitt 8.1:
Pumpenkalibrierung). Der Anwender kann die Pumpendrehzahl über die HMI einstellen und regeln. Der Schlauchdurchmesser ist bei den Rezirkulations-
und Medienpumpen größer als bei den Basen- und Feedpumpen. Bei allen vier Pumpen wird der Schlauch durch eine Schiebe- oder Drehverriegelung in
seiner Position fixiert.
MCV DO
Durchfluss vom MCV
zum Bioreaktor
FBR DO
Durchfluss vom
Bioreaktor zum MCV
Medienfluss
vom MCV
MCV pH

15
Gebrauchsanleitung
Abbildung 5-22. Positionen der peristaltischen Pumpen. Beschreibungen finden Sie in Tabelle 5-8.
Beschriftung Pumpe Richtung der Pumpenrollen Durchfluss Beschreibung
P1 Medienpumpe Im Uhrzeigersinn (CW) Vorwärts (von der Medienflasche
zum MCV)
Pumpendrehzahl: etwa 0,5 bis 700 mL/min
(kalibrierungsabhängig).
Fügt Medien aus dem MCV hinzu (z. B. während des
Medienaustauschs).
Gegen den Uhrzeigersinn
(CCW)
Umgekehrt (vom MCV zur
Medienflasche)
Entfernt Medien aus dem MCV (z. B. während des
Medienaustauschs).
P2 Umwälzpumpe Im Uhrzeigersinn (CW) Vorwärts (vom MCV zum
Bioreaktoreinlass)
Pumpendrehzahl: etwa 0,5 bis 700 mL/min
(kalibrierungsabhängig).
Lässt Medien zwischen dem MCV und dem Bioreaktor
zirkulieren. Lässt Erntelösungen durch den Bioreaktor
strömen.
Gegen den Uhrzeigersinn
(CCW)
Umgekehrt (vom Bioreaktoreinlass
zum MCV)
Lässt die Medien während der Substratprobenahme aus dem
Bioreaktor in das MCV ab.
P3 Feedpumpe Im Uhrzeigersinn (CW) Erweitert (von der Feedflasche zum
MCV)
Pumpendrehzahl: ca. 0,1 bis 80 sccm
(kalibrierungsabhängig).
Fügt dem MCV Nährstoffe zu.
P4 Basenpumpe Im Uhrzeigersinn (CW) Erweitert (von der Basenflasche
zum MCV)
Pumpendrehzahl: ca. 0,1 bis 80 sccm
(kalibrierungsabhängig).
Fügt dem MCV Base zur Erhaltung des pH-Werts hinzu.
Tabelle 5-8. Beschreibungen der peristaltischen Pumpe.
Abbildung 5-23. Die Umwälzpumpe verwendet
robuste Schläuche, die einem kontinuierlichen
Pumpvorgang standhalten.
Abbildung 5-24. Die Abdeckungen der Basen-
und Feedpumpen sind passend zu den farbigen
Clips an den Schläuchen farbkodiert.
5.4 Quetschventile
Es gibt fünf Quetschventile (Abbildung 5-25), die in Verbindung mit den Pumpen den Medienfluss kanalisieren und lenken. Die Farbe des Deckels
jedes Quetschventils entspricht dem farbigen Ring um seinen Fuß. Die orangefarbenen und roten Quetschventile werden für die Medienbefüllung und
-entnahme verwendet. Die gelben, blauen und grünen Quetschventile werden bei der Ernte verwendet.
Die Farbe der Quetschventile hilft dem Anwender beim richtigen Einlegen und Positionieren der Schläuche. Jede Schlauchleitung wird durch farbige Clips
unterschieden, die der Farbe des Quetschventils entsprechen (Abbildung 5-26). Alle Schläuche haben schwarze und weiße Clips, die in der oberen bzw.
unteren Ventilposition eingesetzt werden. Quetschventile sind so bemessen, dass sie mit einem Schlauch-Innendurchmesser (ID) von 0,25 Zoll und einem
Außendurchmesser (OD) von 0,375 Zoll kompatibel sind. In Tabelle 5-9 finden Sie Beschreibungen der Quetschventile und die ihnen zugeordneten Farben.
Robuste Schläuche
Rotierende Pumpenrollen
Schiebeverschluss
Farbcodierte Abdeckung Drehriegel
Drehbare Pumpenrollen
Basenpumpe

16 CORNING ASCENT FBR PD-SYSTEM
HINWEIS: Der weiße Schlauchclip befindet sich immer neben dem Gerät, während der schwarze Schlauchclip außen liegt.
Abbildung 5-25. Positionen der Quetschventile. Beschreibungen finden Sie in Tabelle 5-9.
Abbildung 5-26. Nahaufnahme eines Quetschventils. Das
Etikett auf der Abdeckung zeigt an, wo die Schlauchleitungen
entsprechend der Farbe des Schlauchclips auszurichten und
einzulegen sind.
5.4.1 Positionen der Quetschventile
Die Positionen der Ventile sind wichtig, um den Schlauchfluss zu lenken, wenn das System dies erfordert. Jedes Quetschventil sichert Schläuche in zwei
Ventilpositionen: oben oder unten. Sowohl die obere als auch die untere Ventilposition verfügt über Kolben, die so programmiert sind, dass sie betätigt
werden - angehoben oder eingezogen, je nachdem, wohin die Medien geleitet werden. Die obere Ventilposition, die durch einen schwarzen Balken auf der
Abdeckung des Quetschventils gekennzeichnet ist, ist am weitesten vom Gerät entfernt. Die untere Ventilposition, die durch einen weißen Balken auf der
Abdeckung des Quetschventils gekennzeichnet ist, liegt dem Gerät am nächsten.
Wenn das System eingeschaltet wird, sind die Quetschventile nicht aktiviert. Im stromlosen Zustand ist der untere Ventilkolben so ausgelegt, dass er
ausfährt, während der obere Ventilkolben eingefahren ist (Abbildung 5-27). Das Einlegen der Schläuche erfolgt bei deaktivierten Quetschventilen. Der
Anwender muss die Schläuche zuerst in der unteren Ventilposition und dann in der oberen Ventilposition einlegen.
Sobald eine Phase auf der HMI gestartet wird, werden die Quetschventile mit Strom versorgt. Der obere und der untere Ventilkolben werden je nach
Medienrichtung entsprechend betätigt.
Abbildung 5-27. Ein deaktiviertes Quetschventil beim Einschalten. Der obere Ventilkolben ist zurückgezogen, um einen ununterbrochenen
Schlauchfluss zu ermöglichen. Der untere Ventilkolben ist angehoben, um den unteren Schlauch zusammenzudrücken.
Rotes
Quetschventil
Die Abdeckung des Quetschventils zeigt,
wie Sie die Schläuche zusammenfügen
und positionieren müssen
Farbe und Platzierung der Schlauchclips
müssen mit den Farben auf der Abdeckung
des Quetschventils übereinstimmen.
Orangefarbenes
Quetschventil
Gelbes Quetschventil
Grünes Quetschventil
Blaues Quetschventil
Obere Position
Untere Position
Abdeckung des
Quetschventils Oberer Ventilkolben
zurückgezogen
Fluss freigegeben
Innerer Schlauch ist
eingeklemmt, der Fluss ist
eingeschränkt Unterer
Ventilkolben
angehoben
Quetschventil
Oberer Ventilkolben
zurückgezogen
Innerer Schlauch
ist zusammen-
gedrückt
Unterer Ventilkolben
angehoben
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
Seite laden ...
-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
 26
26
-
 27
27
-
 28
28
-
 29
29
-
 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
-
 39
39
-
 40
40
-
 41
41
-
 42
42
-
 43
43
-
 44
44
-
 45
45
-
 46
46
-
 47
47
-
 48
48
-
 49
49
-
 50
50
-
 51
51
-
 52
52
-
 53
53
-
 54
54
-
 55
55
-
 56
56
-
 57
57
-
 58
58
-
 59
59
-
 60
60
-
 61
61
-
 62
62
-
 63
63
-
 64
64
-
 65
65
-
 66
66
-
 67
67
-
 68
68
-
 69
69
-
 70
70
-
 71
71
-
 72
72
-
 73
73
-
 74
74
-
 75
75
-
 76
76
-
 77
77
-
 78
78
-
 79
79
-
 80
80
-
 81
81
-
 82
82
-
 83
83
-
 84
84
-
 85
85
-
 86
86
-
 87
87
-
 88
88
-
 89
89
-
 90
90
-
 91
91
-
 92
92
-
 93
93
-
 94
94
-
 95
95
-
 96
96
-
 97
97
-
 98
98
-
 99
99
-
 100
100
-
 101
101
-
 102
102
-
 103
103
-
 104
104
-
 105
105
-
 106
106
-
 107
107
-
 108
108
-
 109
109
-
 110
110
-
 111
111
-
 112
112
-
 113
113
-
 114
114
-
 115
115
-
 116
116
-
 117
117
-
 118
118
-
 119
119
-
 120
120
-
 121
121
-
 122
122
-
 123
123
-
 124
124
-
 125
125
-
 126
126
-
 127
127
-
 128
128
-
 129
129
-
 130
130
-
 131
131
-
 132
132
-
 133
133
-
 134
134
-
 135
135
-
 136
136
-
 137
137
-
 138
138
-
 139
139
-
 140
140
-
 141
141
Corning Ascent® Festbettreaktor-Prozessentwicklungssyste Bedienungsanleitung
- Typ
- Bedienungsanleitung












































































































































